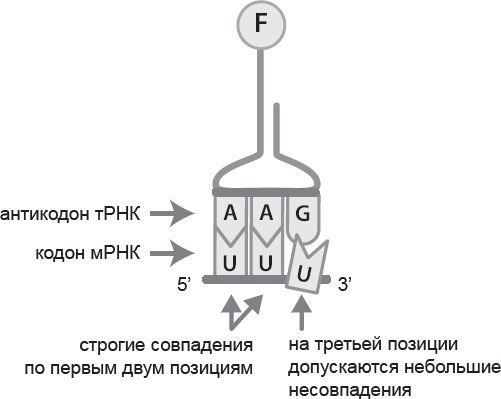
Рис. 14.2. тРНК должна идеально стыковаться кодоном по первым двум основаниям, а по третьему («неоднозначному») – необязательно
Мы изучали антибиотик паромомицин, который повышает количество ошибок считывания кодонов в рибосоме. Синтезированная нами структура 30S с паромомицином показала, что при связывании с этим белком два основания выплетались из своей длинной спирали и оказывались там, где должны находиться кодон мРНК и антикодон тРНК, то есть нарушали специфичность узнавания тРНК. Но подробности этого процесса оставались неясны, поскольку у нас в кристалле не было мРНК и тРНК.
Чтобы понять, как может происходить декодирование, мы пытались делать комплекс из мРНК и тРНК с субъединицей 30S, а еще лучше – с целой рибосомой. Однако с такой кристаллической формой этот прием не работал по странной причине. Существуют два сайта: один удерживает для тРНК растущую белковую цепочку (P-сайт), а другой имеет декодирующий центр, к которому прикрепляется тРНК, подносящая новую аминокислоту (А-сайт). Участок тРНК, называемый шпилькой, связывался с P-сайтом соседней молекулы. Если бы мы добавили мРНК и тРНК к субъединице 30S до кристаллизации, то комплекс заблокировал бы контакт со шпилькой соседней молекулы, что не дало бы сформироваться кристаллу. Но был и другой вариант решения этой проблемы.
Как и в случае с типичными белками, между рибосомными субъединицами существуют каналы с водой, через которые можно внедрять в кристалл мелкие соединения (например, антибиотики), чтобы они просачивались по этим каналам и достигали своего целевого сайта в субъединице 30S. Специалисты давно внедряют лекарства и ингибиторы в кристаллы ферментов, чтобы понять, как эти ферменты действуют.
Мы заметили, что пространство между соседними молекулами 30S в кристалле позволяет вместить мелкие белки или молекулы РНК, в которых более тысячи атомов, гораздо больше, чем в антибиотике.
Ранее никто этого не делал. Эндрю Картер проверил эту идею с белковым фактором IF1, помогающим запустить трансляцию рибосомы. Было известно, что он связывается с A-сайтом. Эндрю взял в Гренобль кристаллы 30S, выдержанные в IF1, а по возвращении торжественно продемонстрировал карты, где четко просматривался этот белок. Так вскоре после расшифровки структуры 30S у нас появился ее снимок с белком, помогавшим рибосоме начать работу.
Мы сразу стали продумывать такой же эксперимент с фрагментами РНК, имитировавшими кодон на мРНК, а также со шпилькой, имитирующей антикодоновую петлю тРНК. Мы надеялись, что один из фрагментов поместится в щель, через которую обычно связывается мРНК, а другой фрагмент сработает как антикодоновая петля тРНК. Это казалось безумием.
Поставить этот эксперимент мы доверили Джеймсу Оглу, новому аспиранту. Он родился в Германии в семье англичан и являл собой образец нового европейца, полиглота, которому уютно во многих странах. Он был одаренным, очень уверенным в себе и имел много других интересов, например замечательно играл на скрипке на любительском уровне. Выполнив эксперименты, он отправился с Дитлевом и другими в Аргонн.
Как только они прислали мне данные, я сразу понял, что происходит. Антибиотик паромомицин не только закрывал собой два первых основания, но и видоизменял третье. Вместе три основания играли роль считывающей головки и вклинивались в бороздку между основаниями кодона и антикодона на уровне первых двух пар оснований, распознавая форму тех пар оснований, что находились между тРНК и мРНК на первых двух позициях, но не на третьей. Фактически субъединица размещалась рядом с кодоном и антикодоном, причем если бы расположенные на первых двух позициях пары оснований имели неподходящую форму, то этого бы не происходило.
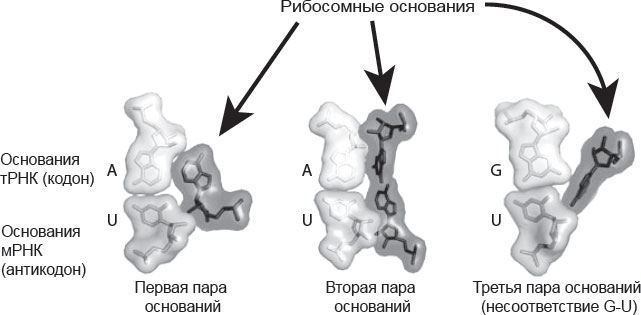
Рис. 14.3. Рибосома распознает форму пар оснований «кодон – антикодон» на первых двух позициях, но не на третьей
Как впервые заметил Уотсон (когда они с Криком догадались о том, что молекула ДНК имеет форму двойной спирали), пары оснований АТ и GC (а также обратные им, ТА и CG) обладают практически идентичными очертаниями, поэтому спираль ДНК могла состоять практически из любых пар оснований и сохранять при этом примерно одну и ту же структуру. То же касается и РНК, где вместо Т присутствует U. Итак, правильные пары оснований имеют характерную форму, отличающую их от несовпадающих, и именно по этому признаку рибосома их находит.
Точность – очень важная концепция в биологии, которая идет на компромисс со скоростью. Излишняя точность замедлит процессы настолько, что они не смогут поддерживать жизнь. Недостаточная точность приведет к сплошному браку. Некоторые антибиотики, в том числе паромомицин, снижают точность работы рибосомы. Так мы выявили базовую причину, объясняющую точность работы рибосомы и смысл такой странной трехбуквенной организации генетического кода, но требующего идеальных совпадений только для первых двух позиций. Как и при образовании пептидных связей, за всю работу отвечает РНК; это подкрепляет идею о зарождении рибосом в древнем мире РНК.
Все это было крайне захватывающе, но в наших более ранних статьях мы уже намекали на то, что происходит с рибосомой под воздействием паромомицина, и я волновался, ведь за прошедшее время группа Гарри улучшила свою структуру 70S, увеличив разрешение с 8 до 5,5 ангстрем. Такое качество позволяло выстроить новую структуру с нуля. Но им к тому моменту этого даже не требовалось, поскольку у них уже были атомные структуры обеих субъединиц, из которых состоит 70S.
Я переживал, что даже если они не смогут рассмотреть детали непосредственно, все равно догадаются, что происходит, так как расставили по местам тРНК и мРНК, а мы годом ранее описали принцип действия паромомицина. Поэтому, только увидев результат, я сразу приступил к работе над черновиком статьи, не дожидаясь, пока Джеймс и другие вернутся из Чикаго. Я знал, что в Science должна выйти статья Гарри, поэтому связался с редактором и сказал, что две эти работы хорошо дополнят друг друга по теме считывания генетического кода. К счастью, редакция согласилась, и наши статьи вышли практически вместе; первым автором в статье группы Гарри значился Марат.
Вдобавок к трем антибиотикам, которые мы разместили в субъединице 30S, Дитлев определил структуры еще трех антибиотиков, в том числе тетрациклина, важного в клинической практике.
Так появились первые опубликованные материалы о том, как антибиотики связываются с рибосомами и выключают их. Один из этих антибиотиков, спектиномицин, связывается с поворотной точкой между головкой и шейкой рибосомы. Головка при движении рибосомы колышется, и, возможно блокируя ее, антибиотик не дает рибосоме двигаться вдоль мРНК. Другой антибиотик, тетрациклин, не дает связываться с рибосомой новым тРНК, так что к растущей белковой цепочке не удается добавить новые аминокислоты, и рибосома словно застревает в колее.




