Главное во всем этом то, что социальное поведение атомов – область науки, которая называется химией – зависит преимущественно от того, сколько атомов находится на внешней орбите. Они как бы комфортнее себя чувствуют на полностью занятой орбите и находятся в постоянном поиске партнеров, чтобы обмениваться электронами и пребывать в покое. Например, если у атома на внешней орбите – семь электронов, он ведет себя как коллекционер, стремящийся заполнить пустующее пространство у себя на полке, и готов прихватить любой электрон, оказавшийся поблизости. Аналогичным образом, если атом только начинает создавать новую орбиту и на ней пока один электрон, он охотно готов с ним расстаться и вернуться в прекрасно организованное спокойное состояние с орбитами, заполненными восемью электронами. Вполне можно представить, что, когда такая великодушная персона встречает коллекционера-маньяка, между ними вспыхивает Любовь. Именно так происходит, когда металлический натрий (тот сверкающий маслянистый брусочек, который мы резали ножом на уроках химии) встречается с газообразным хлором (противный, тяжелый, желтый газ). Они моментально заключают сделку по обмену электроном, после чего мирно сосуществуют в виде хлорида натрия, или поваренной соли.
Кстати, таблица химических элементов называется периодической именно потому, что элементы, имеющие одинаковое количество электронов на внешней орбите, должны вести себя сходным образом. Углерод (C), вещество, из которого состоит почти все, что внутри и вовне нас, имеет четыре электрона для связи, и поэтому составляет максимум четыре союза со своими соседями. Следующий в ряду – кремний (Si), элемент, из которого, говоря языком «Звездного Пути», состоят все «неуглеродные объекты». У него на восемь электронов больше, чем у углерода. Поскольку его следующая орбита заполнена так же (четыре электрона), кремний несколько крупнее углерода, но тоже образует четыре связи, например с водородом, и при этом образуется, например, силан – газ с неприятным запахом. У кислорода и азота на внешней орбите по два или три электрона и они, соответственно, могут устанавливать по две или три связи с соседями, также как их кузены по периодической таблице сера и фосфор. Каждый, кто разделяет любовь к периодической таблице, относится к ней по-своему. Для меня она как групповая фотография одноклассников. Толстые парни – внизу, тощие – наверху, расставлены слева направо по темпераменту, т. е. меланхолики (восемь электронов) на правом краю, сидят рядышком с фосфатами, у которых по семь электронов. Бездумно щедрым типам с одним электроном уютно на краешке слева, а гармоничные и уравновешенные личности, те, кто пойдут (и пошли) далеко по жизни, располагаются где-то посередине.

Хлорид натрия не распадается потому, что его удерживает то, что держит вместе всё остальное – электрические силы. Трудно спокойно воспринимать факт, что весь наш мир склеен теми же силами, которые заставляют клочки бумаги прилипать к натертому пластмассовому стержню, но это так. В случае с хлоридом натрия натрий потерял один электрон и стал положительно заряженным, а хлор приобрел один и стал заряженным отрицательно.
Поэтому они держатся вместе. Но даже нейтральные атомы удерживаются электрическими силами, и причина этого иллюстрируется рисунком вверху, где облако – отрицательное, а ядро – положительное. Если сдвинуть два нейтральных атома (вверху) так, чтобы орбиты их электронов перекрывали друг друга (в середине), то в области перекрытия возникнет аккумуляция электронов. Возьмем два ядра и эту пересекающуюся область (внизу) и получим чудесный маленький сэндвич из положительного-отрицательного-положительного зарядов, которые стремятся быть вместе.
Однако не все так просто, иначе химики не получали бы такие большие зарплаты и не занимали престижные профессорские должности. Каждый электрон на внешней орбите самостоятельно создает свое маленькое облако перекрытия. Это означает, к примеру, что углерод, имеющий на внешней орбите четыре электрона, может создать четыре таких облака, в то время как водород, с одним-единственным электроном, может создать одно.
Соединим один атом углерода и четыре атома водорода и получим молекулу метана, или CH4, изображенную ниже. Он также известен как болотный газ, и это тот самый газ, который сочится из земли в угольных шахтах и убивает людей. Более точное изображение помещено ниже.

Белые атомы водорода на самом деле организуются не в плоскости крестообразной формы, а на максимальном удалении друг от друга, в четырех углах тетраэдра. В целом это несколько напоминает молочные картонки фирмы Tetrapak 1960-х гг. Большинство атомов углерода в итоге создают по четыре связи, и не только с водородом, но и, например, с другими атомами углерода.
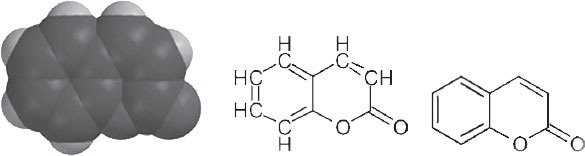
Ну и поскольку мы в теме, посмотрим на структуру кумарина: модель, созданная из шариков, структура, показывающая элементы, и упрощенная нотация, которой пользуются современные химики. В упрощенной нотации предполагается, что все – атомы углерода (связанные с соответствующим количеством атомов водорода и имеющие по четыре связи), если не конкретизировано иное.
Все это выглядит как набор конструктора, и химики любят в него играть. Химики, по традиции, определили цвета для различных атомов, или элементов. Углерод – черный, потому что самая дешевая его форма – графит, используется как грифель для карандашей. Сера – желтовато-зеленый, как цвет природных серных отложений. Кислород – красный, возможно, потому, что химическим веществом, из которого его впервые выделили, был любимый алхимиками оксид ртути, имеющий интенсивный красный цвет.

Маленькие первичные атомы водорода (из которого состоит практически вся наша вселенная) изображаются белым цветом. Азот получил синий цвет, что вполне понятно, если вспомнить, что воздух в небе у нас над головой состоит преимущественно из азота. Эти и все остальные химические элементы имеют еще и буквенные обозначения: C, H, O и N. Нотация, в которой водород опускается, используется химиками для быстрой записи (своего рода «скоропись»). Это скорее не 3D, а 1/2D, но она вполне внятно представляет форму молекул и их взаимодействие. Это и удачная мнемосхема, поскольку у нас прекрасная память на схемы.







