Все клинические испытания в США должны пройти оценку экспертного совета. Это независимый комитет профессионалов, включающий в себя врачей, ученых, статистиков и адвокатов пациентов; его задача – защищать права, безопасность и благополучие участников клинического испытания и минимизировать риски. Пациенты, дающие согласие на испытание, должны быть полностью информированы и защищены.
Лучшие испытания «рандомизируются»: одна группа получает экспериментальное лекарство, другая – стандартное общепринятое лечение. Это позволяет нам сравнивать новую терапию с уже имеющейся. Кроме того, рандомизация гарантирует, что все участники получат либо новое экспериментальное лечение, либо стандартное. В «двойном слепом» исследовании ни пациенты, ни врачи не знают, какое именно лечение получает пациент; это повышает степень доверия к результатам, потому что ученые при этом обычно менее пристрастны в своих оценках. Если вы участвуете в рандомизированном и «двойном слепом» клиническом испытании, то вам об этом сообщают через процесс информированного согласия, и уже после этого вы решаете, участвовать или нет.
Меня часто спрашивают о плацебо: многие пациенты, фантазирующие, как им дадут на клиническом испытании новейшее суперлекарство, боятся, что их отправят в группу плацебо и они ничего не получат. Плацебо – это «пустые пилюли»: внешне они выглядят точно так же, как таблетки, которые изучаются на испытании, но при этом не оказывают никакого действия. (Плацебо могут быть не только таблетками, но и, например, жидкостями или порошками; главное – чтобы они внешне были неотличимы от экспериментального лекарства.) На самом деле в большинстве клинических испытаний, связанных с раком, плацебо мы не используем. Но в некоторых испытаниях плацебо используют, и не зря: иногда это единственный способ определить, работает новый подход или новое лекарство или нет. В этих случаях участников всегда предупреждают через процесс информированного согласия. К тому же любое испытание в любой момент можно прервать, если одна группа показывает значительно лучшие результаты, чем другая. Именно так произошло в апреле 1998 года во время испытаний противоракового препарата тамоксифена. Когда врачи обнаружили, что у женщин из группы риска, участвовавших в испытании по профилактике рака груди, проводимом Национальным институтом рака, при приеме тамоксифена количество случаев рака уменьшилось на 45 процентов, участницам, принимавшим плацебо, тут же предложили перейти на прием настоящего лекарства.
Теперь вернемся к генетическому профилю пациента с раком легких. Это не мой пациент, но я могу привести немало примеров из собственного опыта, которые показывают не только эффективность лекарств в борьбе с раковыми клетками, но и важность дозировки. Нижеприведенная история реальна, но я изменил имя пациента – назовем его Рик. Во введении я вкратце упоминал эту историю.
У Рика рак легких – опухоль, содержащая тот же измененный ген ALK, на который воздействует лекарство церитиниб (зикадия) и еще несколько средств. Поначалу опухоль, пошедшая метастазами по всему телу, прекрасно реагировала на лечение одним из лекарств, нацеленных на ALK. Но со временем, как часто бывает со скрытными видами рака, некоторые клетки смогли избежать лекарства и добрались до его мозга, где тоже стала расти опухоль. В остальном теле рак уже не разрастался и по-прежнему поддавался лечению.
Обсуждая его случай с коллегами, я спросил, что же теперь делать, чтобы бороться с раком. Мое «оружие» не добиралось до мозга Рика из-за гемато-энцефалического барьера, защищающего орган от чужеродных молекул. Эта «стена» должна изолировать мозг, но в данном конкретном случае приносила пациенту вред: она впустила рак, но не пропускала противораковое лекарство. Некоторые коллеги предложили давать лекарство не каждый день, а через день, но большими дозами – в надежде, что оно сможет все-таки «пробить» гемато-энцефалический барьер и попасть в мозг. Я опять-таки действовал вслепую, но терять было нечего, так что я попробовал предложенный способ, и он сработал. На тот момент, когда я пишу эти строки, Рик все еще остается одним из лидеров огромной компании и по-прежнему работает каждый день – почти через четыре года после постановки диагноза «рак легких». Правильное лекарство в правильных дозах может спасти жизнь.
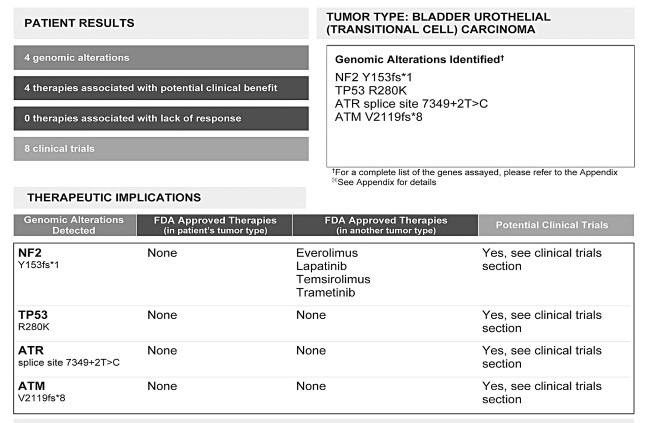
Отчет о секвенировании генов опухоли у пациента с продвинутой стадией рака мочевого пузыря.
Давайте посмотрим на результат еще одного молекулярного теста; у этого пациента рак мочевого пузыря.
Судя по молекулярному тесту, у пациента есть надежда: обнаружено четыре генетических дефекта, связанных с раком, и для одной из мутаций существуют четыре терапии, одобренные FDA. Они могут помочь, правда, эти лекарства одобрены для применения при других видах рака. И, хотя для трех других мутаций известных терапий не существует, сейчас идут клинические испытания, к которым он (или она) может присоединиться. Хочу указать, что, если лекарство не одобрено FDA для лечения конкретной болезни или состояния, это не значит, что врач не может прописать его «не по инструкции». Сразу внесу ясность: если лекарство применяется не по инструкции, это отнюдь не всегда значит, что оно опасное или непроверенное. Некоторые лекарства применяются не по инструкции только потому, что фармацевтические компании решили не тратить дополнительные деньги и усилия, необходимые, чтобы получить одобрение FDA на применение лекарства против определенной болезни – особенно когда речь заходит о редких заболеваниях, которыми страдает лишь горстка людей.
Многие методы лечения рака – это как раз использование «не по инструкции» лекарств, одобренных FDA. Например, многие комбинационные терапии, с помощью которых мы лечим лимфому, рак груди и рак кишечника, не одобрены FDA для лечения именно этих конкретных раков. Лекарства, применяемые не по инструкции, могут помочь многим пациентам, но их не всегда оплачивают страховые компании. Представьте ситуацию: этот пациент с раком мочевого пузыря получает из лаборатории вышеприведенный анализ. Его врач, изучив генетический профиль, рекомендует ему лекарство, но страховая компания говорит, что не будет его оплачивать, а лекарство стоит 100 000 долларов в год или даже больше. В онкологии сейчас такое встречается сплошь и рядом.
Когда-то каждый год появлялась лишь жалкая горстка новых лекарств, но сейчас даже в моей отрасли они поставлены практически на поток. За последние десять лет таргетная терапия лекарствами вроде иматиниба (гливек) и трастузумаба (герцептин) стала стандартом в лечении нескольких видов рака. Эти лекарства атакуют клетки рака, наводясь на специфические молекулярные изменения, заметные только в этих клетках. Сейчас на сцену вышла еще и иммунотерапия, которая позволяет выиграть несколько месяцев, а иногда и лет, так что в скором времени медицина войдет в новую фазу, когда сами клетки станут живыми «лекарствами». Это назвали третьим столпом медицины [11]. Лекарства, полученные благодаря синтетической химии, были первым столпом. Затем, когда в 1978 году компания Genentech научилась производить инсулин в бактериях, случилась революция белковых лекарств. Теперь же лекарственные компании надеются использовать в качестве лекарств наши собственные клетки. В случае с Т-лимфоцитами вообще есть чуть ли не неопровержимые доказательства, что некоторые раки с их помощью можно вылечить вообще без побочных эффектов, за исключением высокой температуры. И если эти результаты будут подтверждены, то тестирование генно-модифицированных Т-лимфоцитов для лечения рака крови может привести к довольно быстрому одобрению этого метода лечения со стороны FDA. Возможно, понадобится всего семь лет, тогда как в среднем для одобрения нового лекарства требуется почти четырнадцать.



