2. Не исключено, что в зиготе изначально имеет место целенаправленное блокирование некоторых ключевых генов, работа которых инициирует транскрипцию. Так, показано, что искусственное введение в эмбрион мощных активаторов транскрипции (транскрипционных факторов «широкого спектра действия») может вызвать преждевременное частичное включение эмбрионального генома.
3. Наконец, сама по себе быстрая череда клеточных делений может мешать транскрипции. Ведь каждому делению должно предшествовать удвоение ДНК (репликация). В ходе дробления репликация должна происходить по сути дела непрерывно. Между тем известно, что репликация может мешать транскрипции, а во время клеточного деления (митоза) могут происходить обрыв и уничтожение тех мРНК, синтез которых еще не закончился. Может быть, клетки эмбриона просто физически не успевают транскрибировать свои гены? Искусственное замедление процесса дробления действительно может вызвать преждевременное включение эмбрионального генома. Кстати, у млекопитающих дробление протекает сравнительно медленно, не этим ли объясняется раннее включение генов зародыша?
Впрочем, ни одна из этих теорий не объясняет всей совокупности имеющихся фактов. Например, они не могут объяснить, почему эмбриональные гены включаются не все сразу, а постепенно, в строго определенном порядке.
Вторым существенным аспектом MZT является уничтожение материнских мРНК. Тут, как выяснилось, все предусмотрено заранее: материнские мРНК помечены особой последовательностью нуклеотидов, расположенной на нетранслируемом (то есть не кодирующем белок) «хвостике» этих молекул. Среди первых генов, которые эмбрион включает в процессе MZT, находятся гены особых белков и маленьких РНК, которые распознают эту последовательность, прикрепляются к ней и тем самым инициируют уничтожение материнских мРНК.
До полного понимания всех этих процессов науке еще очень далеко, но дело движется. Когда основные механизмы генной регуляции в ходе раннего онтогенеза будут расшифрованы, биологи смогут вплотную заняться следующим принципиальным вопросом, а именно — зачем все это надо? Почему животные не доверяют своему геному контроль над ранними стадиями развития, а потом в какой-то момент вдруг «переключаются» с материнских мРНК на свои собственные?
Между прочим, эта проблема имеет не только теоретическое, но и практическое значение. Трудности, с которыми сталкиваются работы по клонированию животных, во многом определяются тем, что мы еще слишком мало знаем о работе генов в ходе раннего развития. Клонирование животных осуществляется путем пересадки ядра из соматической (неполовой) клетки одного животного в яйцеклетку другого. Однако для нормального развития необходимо, чтобы гены зародыша поначалу помалкивали, а они в донорском ядре вполне активны. Цитоплазма яйцеклетки должна каким-то образом «перепрограммировать» ядро, выключить геном, а потом в нужный момент снова включить его. Пока мы не знаем, как ей в этом помочь, больших успехов в клонировании ожидать трудно.
—————
Разгадан механизм регенерации конечностей. «Генетическая программа» индивидуального развития очень тесно связана с другой «программой», на основе которой происходит регенерация — заживление ран и отращивание утраченных частей тела. Изучая регенерацию, ученые одновременно проникают в тайны онтогенеза и наоборот.
Биологи из Испании и США недавно провели серию генно-инженерных экспериментов, в результате которых им удалось показать, что регенерация конечностей у позвоночных идет под управлением тех же регуляторных белков, которые руководят развитием конечностей у эмбриона. Белки, о которых идет речь, образуют два сигнально-регуляторных каскада, которые называются Wnt/beta-catenin (о роли белка Wnt в развитии червя Caenorhabditis elegans говорилось выше в сюжете «Развитие червей начинается с хвоста») и BMP (по названию ключевого участника каскада — белка BMP, bone morphogenetic protein).
Для первого эксперимента ученые сконструировали специальный вирус, в геном которого был встроен ген белка, блокирующего работу Wnt-каскада. Введение вируса аксолотлю снизило способность к регенерации. У аксолотля в норме отрезанные конечности восстанавливаются полностью, однако у зараженных искусственным вирусом аксолотлей вместо лапы вырастала лишь заостренная культя без пальцев.
Этот эксперимент показал, что нормальная работа Wnt-каскада — необходимое условие регенерации, но является ли она также и достаточным условием? Чтобы проверить это, ученые поставили эксперимент на шпорцевой лягушке, у которой в отличие от аксолотля способность к регенерации есть только у головастиков, а с возрастом эта способность теряется. Был сконструирован еще один вирус, производящий белок бета-катенин — один из ключевых участников Wnt-каскада. Введение этого вируса улучшало способность шпорцевых лягушек к регенерации конечностей на тех стадиях развития, когда эта способность уже ослаблена. Однако у взрослых лягушек, полностью потерявших способность к регенерации, этого не наблюдалось. Следовательно, для регенерации необходимо что-то еще, кроме Wnt-каскада.
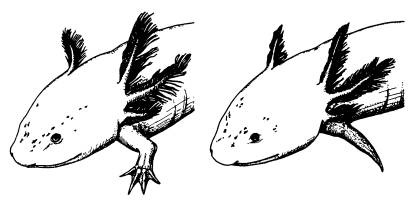
Нормально регенирировавмая после ампутации конечность аксолотля (слева) и недоразвитая конечность у особи, которой был введен Axin1 — ингибитор Wnt-каскада.
Третьим подопытным объектом стала рыбка данио (Danio rerio). В норме эта рыбка способна заново отращивать утраченные плавники. Ранее было показано, что различные ингибиторы Wnt-каскада снижают эту способность (так же как у аксолотля и шпорцевой лягушки). Чтобы проверить, способно ли активирование Wnt-каскада усилить способность к регенерации у данио, исследователи использовали рыбок, потерявших эту способность в результате мутации. Введение таким рыбкам бета-катенинового вируса привело к частичному «исправлению» данного дефекта. На данио исследователям удалось также показать, что для успешной регенерации помимо Wnt-каскада должен нормально работать и сигнально-регуляторный каскад BMP.
Самое интересное, что оба каскада (Wnt и BMP) руководят и развитием конечностей у эмбрионов. На клеточно-тканевом уровне оба процесса — регенерация и развитие конечности в эмбриогенезе — тоже очень сходны. Все эти данные указывают на то, что восстановление утраченных конечностей осуществляется на основе той же самой программы развития, которая руководит формированием конечностей у эмбриона. И эту программу, по-видимому, можно искусственно «включить» даже у тех животных, которые в норме вообще не способны восстанавливать утраченные конечности. Ведь программа эмбрионального развития есть у всех!
Ученым удалось подтвердить это предположение в опытах на курином эмбрионе. Удаление особого многослойного эпителия, расположенного на верхушке зачатка крыла, приводит к недоразвитию крыла. Однако оказалось, что, если активировать у цыпленка ген бета-катенина, крыло после такой ампутации развивается гораздо лучше.



