Однако отравления цианидом происходят не только в беллетристике, фильмах и при несчастных случаях при добыче золота. Некоторые виды сырой маниоки (Manihot esculenta), растения, которое служит пищей для полумиллиарда людей в странах третьего мира, содержат достаточное количество цианида – в килограмме сырой маниоки содержится столько цианида, сколько достаточно для того, чтобы убить шестерых.
К счастью, методы кулинарной обработки маниоки (если всё делать правильно) приводят к тому, что в килограмме содержится половина смертельной дозы цианида, и поскольку он не аккумулируется, это не так опасно. Тем не менее в 1980-е годы в Африке регистрировалось немалое количество отравлений цианидами: причина заключалась в том, что люди ели маниоку сырой или не предпринимали меры предосторожности при готовке. Определенное количество цианидов содержится также в косточках вишни, черешни, абрикосов и других косточковых – во время дефицита спиртного в СССР временами регистрировались случаи смертельного отравления цианидами из-за потребления самодельных настоек на косточковых, из которых косточки не были в своё время удалены.
Несмотря на опасности отравления цианидами и циановодородом, существует определенное количество антидотов от этих отравлений. Кстати – сахар ни в коем разе не является антидотом от ОТРАВЛЕНИЯ цианидом (когда железо оксидазы уже блокировано цианидом, лопать сахар примерно так же своевременно, как пить боржоми при отказе почек) – он может только частично связать цианиды в напитке или пирожном, которым собираются кого-то отравить. Действие антидота в данном случае основано на том, что антидот имеет большее сродство к цианид-иону, и цианид связывается с ним, освобождая железо фермента-оксидазы. Такой молекулой, которая может «пожертвовать собой», является гемоглобин, но для того чтобы гемоглобин мог связываться с цианидом, необходимо окислить железо (II) гемоглобина до железа (III) – это может быть сделано за счет введения нитрита натрия или 4-диметиламинофенола. Ещё одна молекула, которая может играть роль антидота при цианидном отравлении, – гидроксикобаламин, производное витамина B12, которое «перехватывает» цианид от ингибированной оксидазы за счет атомов кобальта.
Для того чтобы можно было быстро понять, стоит ли принимать противоцианидный антидот, и если стоит, то в каком количестве, Кристин Мэннель-Круазе (Christine Männel-Croisé) и Феликс Цельдер (Felix Zelder) из Университета Цюриха в 2012 году разработали аналитический метод, который позволяет диагностировать отравление цианидами за две минуты, при этом для проведения анализа не требуется сложного оборудования – анализ может быть проведен в полевых условиях.
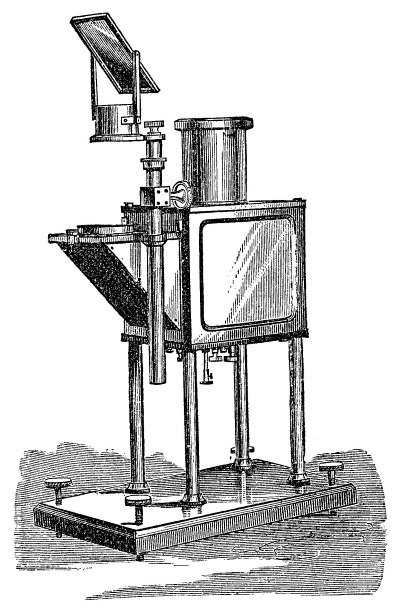
У пострадавшего отбирается образец крови и с помощью буфера рН образца доводится до уровня 9,6. Далее к полученному раствору добавляется оранжевый кобальтосодержащий сенсор (этот сенсор был ранее разработан и синтезирован исследователями), и раствор с помощью давления, создаваемого штоком шприца, пропускают через колонку для фазовой экстракции, после чего отмывают колонку от крови водой. При наличии в образце крови цианида он образует окрашенный в лиловый цвет комплекс с химическим сенсором. Этот комплекс будет локализован в верхнем слое расположенного в колонке сорбента, что можно увидеть невооруженным глазом.
Несмотря на токсичность циановодорода и его опасность, отказываться от его применения и производства человечество не собирается – ежемесячно производится достаточное количество циановодорода, чтобы убить каждого человека на Земле, но, конечно, производят его не для этого, а для применения в качестве реагента в химической промышленности.
Примером одного из материалов, для производства которого применяется циановодородная кислота, является известный полимер нейлон: исходным для его получения веществом является адипонитрил, который, в свою очередь, получают, присоединяя циановодород к двойным связям бутадиена.
Несмотря на то что циановодород смертельно опасен для большинства современных форм жизни на Земле, в свое время эта молекула могла сыграть роль и в процессе возникновения жизни. Циановодород, который, кстати, может формироваться и в космическом пространстве, и, возможно, мог формироваться в атмосфере молодой Земли, в соответствии с некоторыми гипотезами рассматривается как предшественник аминокислот и нуклеиновых кислот.
Вот такой он, циановодород – простая линейная молекула из трёх атомов, возможно, когда-то способствовавшая возникновению жизни на Земле, известный герой романов и фильмов, золотодобытчик и специалист по синтезу огромного количества органических соединений – от лекарств до полимеров.

1.7. Озон
Для большинства людей озон ассоциируется ни с чем иным, кроме как с дырами в атмосфере в полярных районах и концепцией: «Аааа, мы все умрем!» Кто-то наоборот, считает запах озона ароматом свежести и обновления. Однако о свойствах озона, обуславливающих появление этой дыры, а также о том, что озон в верхних слоях атмосферы защищает жизнь на Земле, а озон в нижних слоях атмосферы опасен для здоровья, известно меньше.
Озон является аллотропной модификацией кислорода. Молекулярный кислород, образующий с азотом и другими газами смесь, которую мы называем воздухом, состоит из двух атомов кислорода и с точки зрения номенклатуры должен называться «дикислород».
Озон – ближайший родственник дикислорода, но состоящий из трёх атомов кислорода. Тем не менее такая относительно простая молекула, столь близкая по строению к дикислороду, долгое время была загадкой для химиков XIX столетия.
Озон – бледно-голубой газ с характерным, несколько резковатым запахом (этот запах можно почувствовать, понюхав воздух у работавшего продолжительное время без перерыва ксерокса или лазерного принтера).
Название «озон» происходит от греческого слово «озеин» – запах. Это имя газ получил в 1840 году, его крестным отцом стал успевший поработать и в Германии, и в Швейцарии химик Кристиан-Фридрих Шенбейн, которому часто приписывают и пальму первенства в открытии озона. Тем не менее впервые озон обнаружил не Шенбейн, а голландский физик Мартин ван Марум (в 1785 г.) – именно он описал характерный запах и окислительные свойства, которые приобретает воздух после пропускания через него электрических искр.
Однако ван Марум считал, что образуется особая «электрическая материя», на открытие нового вещества он не претендовал, и до Шенбейна общепринятым было мнение о том, что запах озона – это «запах электричества». Итак, Шенбейн первым заявил об озоне как о новом химическом веществе, но молекулярная формула озона – O3 – была установлена позже: это было связано с трудностями при выделении и очистке озона от других газов, а эти трудности, в свою очередь, являлись результатом высокой реакционной способности озона.

