Молчаливый убийца обладает жестоким чувством юмора – благодаря тому, что кровь насыщена кислородом, у жертв отравления угарным газом сохраняется здоровый румянец (как в анекдоте: ну как живые сидели). Несмертельные отравления угарным газом могут вызывать тошноту, головокружение и необратимые повреждения мозга, при больших дозах угарного газа и/или времени нахождения в атмосфере, содержащей угарный газ, у человека могут появляться галлюцинации, происходить потеря сознания с конвульсиями и дыханием Чейн-Стокса.

Современные «канарейки», предупреждающие о превышении опасной концентрации угарного газа, можно приобрести не только в «промышленном» исполнении, но и в «карманном варианте» – для персонального использования (если читатели доверяют изделиям китайских умельцев, то на али-экспрессе такой датчик можно купить за сумму не дороже 500 рублей). Для человека, относящегося к группе повышенного риска к бытовому отравлению угарным газом (коттедж или дачный дом с собственной системой отопления, своя банька), возможно, весьма полезная инвестиция в собственную безопасность.
Ранее химическое определение угарного газа проводили так: через слой оксида кремния, модифицированного хлоридом палладия, пропускали анализируемую смесь газов, при наличии в смеси угарного газа он восстанавливал палладий до металла, и наблюдалось потемнение, сейчас датчики работают, как спектральные сигнализаторы, способные обнаружить тройную углерод-кислородную связь, которая характерна только для угарного газа.
Кстати, фильтрующие противогазы, как военные, так и гражданские, от угарного газа не защитят – молекула СО слишком мала и легко проходит через угольный фильтр, в данном случае помогает только изолирующий противогаз, он же дыхательный аппарат, который полностью изолирует органы дыхания человека от окружающей среды.
Угарный газ хотя и является убийцей, тем не менее вырабатывается и организмом человека. Возможно, это связано с тем, что в те времена, когда атмосфера Земли была богата угарным газом, зарождение определенных биологических механизмов на этой ранней стадии развития жизни вполне могло обуславливаться этой молекулой.
Организм человека продуцирует 3–6 мл угарного газа в день, причем определенные воспалительные процессы (а также патологические состояния) могут значительно увеличить это количество. Эндогенный (вырабатывающийся организмом человека) угарный газ играет роль регулятора кровяного давления при стрессах и нейрональной защиты при апоплексии и болезни Альцгеймера; в конце ХХ века было установлено, что угарный газ является нейротрансмиттером (участвует в передаче информации между нервными клетками) для клеток гиппокампа.
Угарный газ, он же моноксид углерода, был впервые идентифицирован шотландским химиком Уильямом Крюйкшенком из Вулиджа в 1800 году – он первым выделил его из коксового газа. Современный лабораторный способ получения угарного газа основан на дегидратации (отщеплении воды) муравьиной кислоты.
Угарный газ сгорает голубым пламенем с образованием углекислого газа и часто, в форме «генераторного» газа, применяется в качестве топлива. Генераторный газ, который получают, пропуская воздух над раскалённым каменным углём или коксом в специальных печах – газогенераторах, даже использовался в качестве топлива во время Второй мировой. Ещё одно применение угарного газа – процесс Монда – очистка никеля, основанная на том, что угарный газ легко реагирует с никелем, образуя жидкий при комнатной температуре и летучий тетракарбонилникель Ni(CO)4, который отгоняют (как в самогонном аппарате) и разрушают до металлического никеля.

Итак, хотя опасность угореть и не встать потенциально остается и до сих пор, угарный газ, как, впрочем, и почти любое химическое вещество, которым можно отравиться, играет определенную положительную роль и в нашем организме, и в промышленности. В общем, читатели, дышите свежим воздухом, радуйтесь жизни, но при этом не угорайте от угарного газа.
1.9. Веселящий газ, который не надо путать с угарным
Веселящий газ (N2O) – он же закись азота, он же оксид азота(I), он же, как любят говорить школьные учителя химии, «оксид одновалентного азота». Последнее, кстати, совершенно неправильно – ни одного атома одновалентного азота в закиси азота нет. Его строение таково:
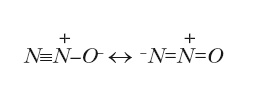
Небольшое скучное отступление о природе химической связи – почему так сложно, а не так, как лихо любят рисовать школьные учителя и обученные ими дети: N – O–N? Все просто – у атома азота на внешней оболочке находятся три неспаренных (валентных) электрона. В гипотетической частице N – O–N по одному электрону от каждого атома азота идёт на образование связи с кислородом, и у каждого атома азота осталось бы по два неспаренных электрона, а у N – O–N должно быть ЧЕТЫРЕ неспаренных электрона. Строго говоря, частица с одним неспаренным электроном уже реакционноспособна (такие частицы, например – те самые радикалы-оксиданты, которыми СМИ пугают легковареных слушателей), а система с четырьмя неспаренными электронами должна реагировать с чем угодно «стремительным домкратом». Так вот – регулярно рассказываю это на курсах учителям, они добросовестно записывают, кивают, но потом возвращаются в школы и продолжают учить детей формуле N – O–N. Всё ж таки сложнее всего учить химии именно школьных учителей химии – любые попытки сломать их устоявшиеся представления о жизни и химии либо встречаются в штыки, либо игнорируются.
Закись азота была одним из газов, открытых в период развития химии, известного как «пневматическая химия», одним из известных химиков того времени – Джозефом Пристли. В 1772–1774 годах. Пристли открыл «щелочной воздух» – аммиак. Он детально исследовал полученный им при взаимодействии поваренной соли и серной кислоты «солянокислый воздух» – хлористый водород, который он собрал над ртутью. Действуя разбавленной азотной кислотой на медь, получил «селитряный воздух» – окись азота; на воздухе этот бесцветный газ бурел, превращаясь в диоксид азота. Пристли открыл закись азота, пропуская «селитряный воздух» через воду. В настоящее время закись азота получают, нагревая нитрат аммония, который распадется на воду и закись азота.
То, что закись азота вызывает эйфорию и обладает анестезирующими свойствами, было обнаружено довольно рано – это выяснил ещё один представитель пневматической химии Хэмфри Дэви где-то в 1790-х годах. Однако первый задокументированный пример практического использования закиси азота в медицине датируется 1844 годом, и первым человеком, применившим закись азота для анестезии, был американский дантист Хорас Уэллс.

