Маркерами в ДНК, на которые они обратили внимание, были те самые полиморфизмы длин рестрикционных фрагментов. ПДРФ, Restriction fragment length polymorphism, RFLP – способ исследования геномной ДНК путем разрезания ДНК с помощью эндонуклеаз рестрикции и дальнейшего анализа размеров образующихся фрагментов (рестриктов) путем гель-электрофореза (электрофореза ДНК). Напомню, что большинство ферментов-рестриктаз режут ДНК только в том месте, где встречают конкретную палиндромную последовательность. Если генетическая «буква» в этом месте изменится, то фермент больше не сможет разрезать ДНК в прежнем месте. Чаще всего эти повторы, которых в нашем геноме миллионы, встречаются в мусорной ДНК и потому в практическом отношении не имеют функционального эффекта.
После семинара в Альте Ботстейн, Дэвис и Школьник вместе с Рэем Уайтом, тогда работавшим в Университете штата Массачусетс, стали исследовать феномен полиморфизма длин рестрикционных фрагментов. В 1980 году на основе материала, полученного в процессе их сотрудничества, была написана эпохальная статья, открывшая новую страницу в молекулярной генетике человека. В статье был предложен четкий план того, как при помощи ПДРФ-маркеров можно построить карту маячков-маркеров в каждой человеческой хромосоме. Дэвид Ботстейн с коллегами вычислили, что 150 ПДРФ, равномерно распределенных по всему геному, вполне хватит, чтобы выявить мутантные гены, вызывающие болезнь. Собирая образцы ДНК в семьях, состоящих из нескольких поколений, в которых болезнь поражает предков и потомков, можно поочередно отследить закономерности наследования ПДРФ, отыскивая именно те гены, из-за которых болезнь сохраняется в семьях и которые показывают расположение мутантного гена.
В 1983 году Хелен Донис-Келлер (в ту пору жена Дэвида Ботстейна) основала Отдел генетики человека в бостонской компании Collaborative Research, Inc. Она стремилась построить карту сцепления ПДРФ в масштабах всего человеческого генома. Через четыре года после описываемых событий она опубликовала результаты своей работы в статье, метко названной «Карта генетических сцеплений в геноме человека». На этой карте было 403 маркера (гораздо больше, чем по исходной оценке Дэвида Ботстейна), охватывавших добрых 95 % генома. Та первая карта не была совершенной; например, некоторые хромосомы имели четко установленное место, расположение других подвергалось сомнению. Тем не менее возможность составления такой карты показала, что картирование всего генома осуществимо, что было важным достижением тех лет.
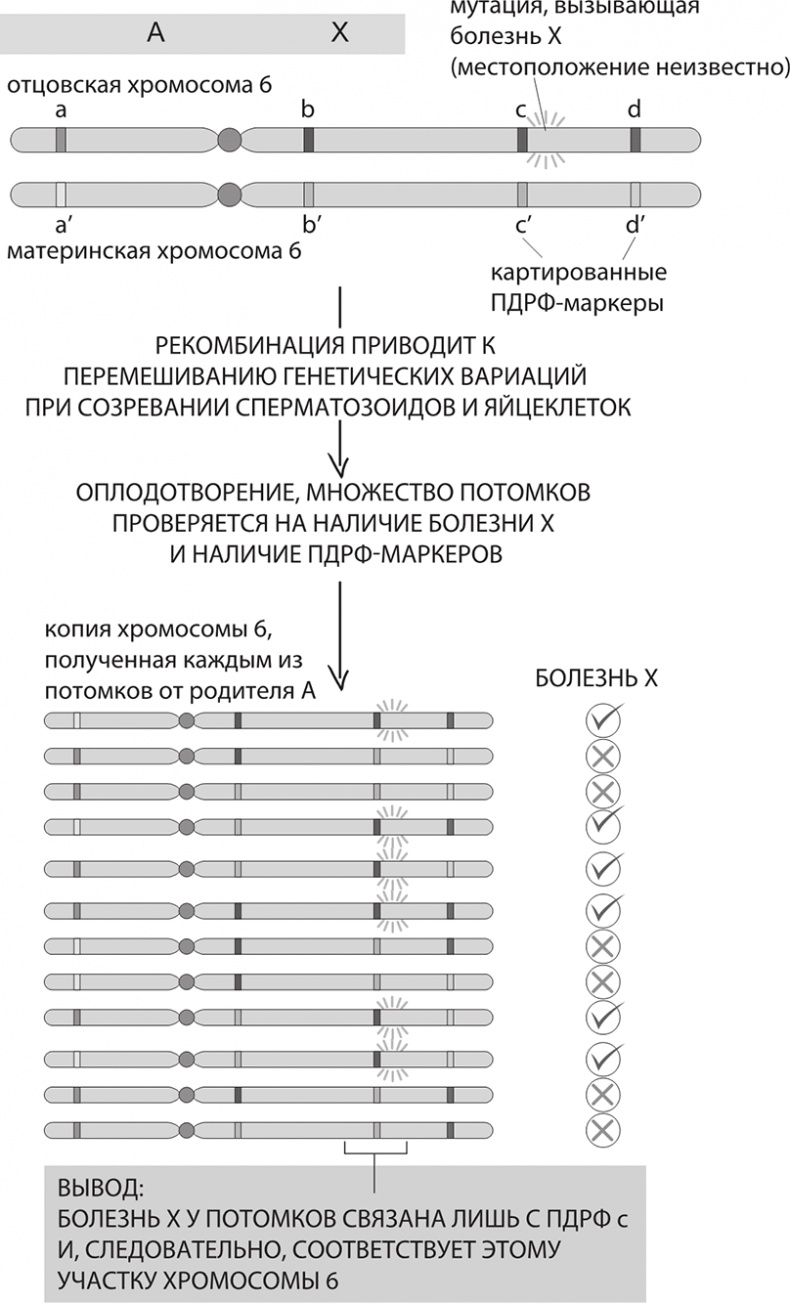
Генетическое картирование гена, отвечающего за болезнь. Для удобства показаны всего два поколения и лишь несколько индивидов. Чтобы анализ обладал статистической мощностью, в нем необходимо учесть большое число родственных индивидов
По мере того как работа по созданию подробной генетической карты набрала обороты, Дэвид Хаусман (David Houseman) из Массачусетского технологического института был готов начать работу, которую Ботстейн на данном этапе считал невыполнимым делом. Дэвид Хаусман поставил себе цель: локализовать ген болезни Хантингтона. Решить эту амбициозную задачу он поручил Джиму Гузелле, только что получившему звание PhD в лаборатории Хаусмана. Поначалу Ботстейн был настроен пессимистично, это было связано с отсутствием маркеров, необходимых для работы: ПДРФ хорошо выглядели только на бумаге, на тот момент работа по их сбору и анализу только началась. К 1982 году у Джима Гузелле было всего 12 ДНК-маркеров. Нэнси Векслер тем временем вернулась на Маракайбо и пыталась уточнить ранее собранную генеалогию: выяснить, кто и с кем вступал в брак, состояние здоровья их детей, кто кому приходился кузеном. Всего в одном семейном генеалогическом дереве, которое удалось выстроить Векслер, насчитывалось 17 тысяч имен! Помню одно из собраний, состоявшееся в Колд-Спринг-Харборе в октябре 1982 года, когда Джим Гузелла представил свои самые новые данные. Ни один из первых пяти маркеров не давал даже намеков на находку сцепления между генами, и меня не покидала мысль, что вся эта работа напоминает поиски иголки в стоге сена, а Джим Гузелла пока вытащил из стога всего несколько соломинок. Когда он завершил свою речь словами: «Обнаружение гена болезни Хантингтона – всего лишь дело времени», я про себя добавил: «Безусловно, только очень долгого времени».
Но удача любит смелых. К изумлению Гузеллы и всех прочих, двенадцатый маркер, обозначенный G8, оказался связан с болезнью Хантингтона. Впервые ген человеческой болезни удалось найти в хромосоме, не опираясь на данные о сцеплении с полом и не обладая никакими исходными знаниями о биохимической основе расстройства. Внезапно открылась новая научная перспектива: нам показалось, что в конце концов удастся проанализировать все те генетические дефекты, которые были бичом рода человеческого с начала времен его существования. Оказалось, что полиморфизмы длин рестрикционных фрагментов – очень действенный диагностический инструмент. После обнаружения гена болезни Хантингтона на конце короткого плеча 4-й хромосомы наши мощные методы клонирования генов, определенно, позволят выделить сам этот ген – это лишь дело времени, причем весьма недалекого.
Болезнь Хантингтона творит свое черное дело уже со взрослыми людьми. Мы знаем, что очень часто генетические болезни поражают детей, и они тем более ужасны, поскольку их жертвы практически не имеют шансов порадоваться этой жизни. Часто после постановки диагноза можно с суровой определенностью описать всю дальнейшую жизнь ребенка. Именно такая ситуация складывается с миодистрофией Дюшенна – прогрессирующим заболеванием, которое истощает мышцы, вызывает затруднения при движениях с детского возраста, которые прогрессируют с течением времени. Миодистрофия Дюшенна сцеплена с полом: вызывающая это заболевание мутация локализуется в X-хромосоме. Женщин, имеющих хромосому с такой мутацией, обычно спасает от болезни вторая, нормальная копия этого гена в другой X-хромосоме. Однако если хромосома с мутантным геном передается сыну, то мальчик заболеет миодистрофией Дюшенна, так как не имеет второй X-хромосомы с нормальной копией гена. Когда ребенку будет около пяти лет, родители заметят, что ему сложно встать с пола или подняться по лестнице. Примерно к десяти годам он окажется в инвалидной коляске. Вероятнее всего, больной умрет в подростковом возрасте либо проживет чуть больше двадцати лет.
В конце 1970-х годов цитогенетики (ученые, изучающие хромосомы под микроскопом) обнаружили аномалию в коротком плече X-хромосомы, встречающейся у тех считаных девочек, которые подвержены миодистрофии Дюшенна. Речь идет об участке Xp21. Анализ сцепления, выполненный Бобом Уильямсоном из Медицинской школы при больнице Святой Марии в Лондоне, а также его коллегой Кей Дэвис (в замужестве Дейм), подтвердил, что все дело в участке Xp21. Тем временем генетики-клиницисты воспользовались полиморфизмами длин рестрикционных фрагментов в качестве диагностического инструмента, позволяющего определить, кто из членов той или иной семьи (не исключая этапа внутриутробного развития) несет такую мутацию. Например, если у женщины есть мутация, провоцирующая миодистрофию Дюшенна, то ее сын с вероятностью 50 % заболеет этим недугом. Впервые в истории с помощью метода ПДРФ врачам удалось внутриутробно определить риск рождения ребенка с генетическим заболеванием.



