Устойчивость к химическому воздействию развивается по отношению к активным формам кислорода, не только поступающего извне, но и образующегося внутри организма. Практически все RAS-активируемые клетки генерируют активные формы кислорода, передавая сигналы, которые сначала включают рибосомные механизмы синтеза белков, а затем добавляют молекулярную оснастку для цикла деления митотических клеток. Поэтому уровни активных форм кислорода в растущих клетках, претерпевающих клеточный цикл, неизбежно выше, чем в аналогичных им клетках, которые не делятся. Еще больше активных форм кислорода обнаруживается в раковых клетках, действующих на основе онкогенов (там, где сигнализация, стимулирующая клеточный рост, всегда включена). Серьезную проблему представляют критически высокие уровни активных форм кислорода при раке легких, поджелудочной железы и прямой кишки (управляемых онкогенами KRAS). Соответственно, они генерируют и массу антиоксидантов, активируя фактор транскрипции NRF2; поэтому такие виды рака считаются видами, хуже всего поддающимся химиотерапии.
К счастью, сегодня онкологи все активнее принимают некогда вызывавшую неприятие идею о том, что выборочное уничтожение раковых клеток активными формами кислорода может быть связано с высокими уровнями активных форм кислорода, обусловленных действием онкогенов. Мнение обывателей заключается в том, что рак побеждает человека, потому что «такой здоровый» и на нем удобно создавать собственную среду для размножения клеток. На самом же деле опухолям в нашем организме не хватает многих важнейших питательных веществ, поскольку активные формы кислорода угнетают функцию митохондрий. «Здоровья» раку хватает лишь на то, чтобы как-то существовать. Однако что еслиудастся нарушить этот шаткий баланс, резко снизив в опухоли уровень антиоксидантов (то есть заблокировав синтез тех антиоксидантов, которых в клетках больше всего)?
Хотя наиболее активным антиоксидантом является глутатион, первые клинические испытания, в которых планировалось исследовать ингибирование его синтеза, почти не принесли результатов – возможно, из-за того что не удалось одновременно блокировать биохимический путь синтеза альтернативного антиоксиданта, тиоредоксина. Напротив, если одновременно отключить защитные биохимические пути обоих этих ключевых антиоксидантов, развитие различных патологических процессов быстро замедляется, а сами они протекают не так тяжело (подтверждено на подопытных животных). Лекарства, блокирующие биохимические пути глутатиона и тиоредоксина, применяются при лечении ревматоидного артрита и, возможно, скоро будут опробованы и в онкологических клинических испытаниях на людях. Уже существуют убедительные доказательства того, что регулярные инъекции витамина Е (мощного антиоксиданта) усиливают, а не угнетают рак легких и рак простаты у человека.
С той поры конца 1990-х, когда набирал обороты проект «Геном человека», удалось добиться серьезного прогресса и в описании онкологических процессов на генетическом уровне. Это было связано с появлением ДНК-чипов. Первопроходцами в этой сфере выступили Патрик Браун из Стэнфорда и Дэвид Ботстейн, а коммерческим распространением чипов занималась компания Affymetrix. Одновременно измеряя активность десятков генов в раковых клетках (подсчитывая, сколько фиксируется операций транскрипции РНК от каждого гена) и сравнивая результаты с показателями здоровых клеток, ученые смогли выявить характерные изменения уровня экспрессии генов в тех опухолях, которые под микроскопом казались совершенно идентичными.
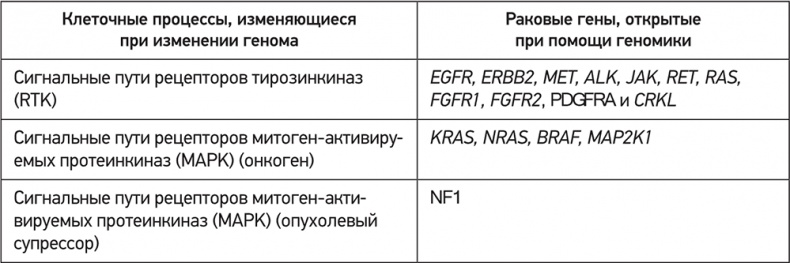
Мутации раковых генов, классифицированные по биологическим функциям и биохимическим путям. В таблице перечислены важные гены, мутирующие в ходе различных клеточных процессов
К 1999 году удалось получить воспроизводимые опытным путем изменения в экспрессии генов и четко отделить клетки острого миелоидного лейкоза от клеток острого лимфобластного миелоидного лейкоза.
После первых исследований в этом направлении потребовалось почти десять лет, чтобы Элен Мардис и Рик Уилсон, тогда работавшие в Институте генома им. Макдоннелла при Вашингтонском университете в Сент-Луисе, сочли, что новые технологии секвенирования ДНК достаточно окрепли и можно взяться за полное секвенирование генома пациента, больного раком. Однако эксперты, оценивавшие заявку Элен Мардис и Рика Уилсона на грант, с ними не согласились. Элен Мардис вспоминала, что рецензенты «откровенно зарубили» ее планы; они подчеркивали, что разумнее было бы сосредоточиться на изучении отдельных генов или участков с активными мутациями, в не заниматься кропотливым секвенированием всего генома, потратив на это немалые деньги. Тем не менее команда из Сент-Луиса не отступилась, и вскоре усилия уже принесли первые плоды. Результаты полногеномного секвенирования первого ракового генома были опубликованы в 2008 году. Прошло более двадцати лет с тех пор, как мой друг, нобелевский лауреат Ренато Дульбекко, небесспорным образом поддержал идею секвенирования ракового генома. «Если мы хотим подробнее изучить рак, то сейчас должны сосредоточиться на свойствах клеточного генома, – писал он в комментарии в журнале Science. – Есть два варианта. Либо по одному выявлять гены, вызывающие злокачественные новообразования… либо в целом секвенировать весь геном».
Со времени эпохального отчета, составленного группой из Сент-Луиса, отсеквенировано уже множество раковых геномов, что помогло лучше определить спектр мутационных механизмов, стимулирующих рост опухолей. Вооружившись материалами программ Национального онкологического института, и в частности «Атласом ракового генома» (TCGA) – исчерпывающими каталогами генетических вариантов и генетической активности в десятках видов опухолей у тысяч пациентов, мы до сих пор обнаруживаем новых генетических персонажей в онкологической трагедии. Среди них множество генов, которые ранее никто и не думал подозревать в связи с раком. Красота систематических полногеномных исследований рака в том, что они дают непредвзятую картину всего спектра раковых мутаций. Мы больше не ограничены лишь тем набором генов, которые осознанно ищем. Уже известно, что при различных онкологических заболеваниях возникают мутации примерно в трех сотнях генов; ученые составили схемы тех процессов и биохимических путей, когда эти пути нарушаются. Гены могут быть связаны с метаболизмом, клеточным циклом, эпигенетикой, модификацией гистонов, генетической регуляцией и обеспечением целостности генома. Наконец-то за деревьями начал просматриваться лес. Пестрое множество мутантных генов постепенно упорядочивается в виде удобоваримого списка путей и процессов, которые нарушаются при раке.

Первооткрыватель лекарств Джей Бреднер (слева) знакомится с исследовательскими данными в компании Novartis
Недаром Джей Бреднер, онколог, ранее работавший в Институте онкологических исследований Даны Фарбер в Гарварде, а теперь возглавляющий отдел НИОКР в кембриджской компании Novartis, называл RAS, MYC и p53 «тремя неуязвимыми всадниками ракового апокалипсиса». Они стали такими знаменитыми мишенями не только потому, что так распространены, но и потому, что десятилетиями стимулировали разработку лекарств, упрямо не давая ни одной подходящей молекулярной канавки, которую мог бы заблокировать мелкомолекулярный препарат. Поэтому химики между собой называют их лекарственно недосягаемыми («undruggable»). В то время как большинство белков услужливо предлагают сколько угодно уголков и закоулков, где может разместиться маленький ген, RAS, например, является совершенно ровным, и там решительно негде закрепиться.





