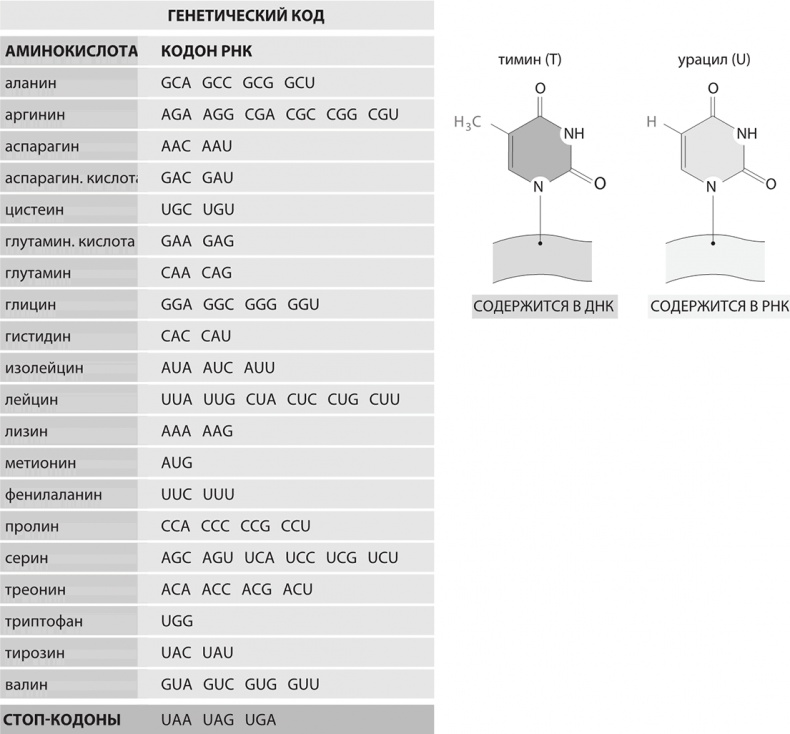
Генетический код, демонстрирующий последовательности триплетов в матричной РНК. Важное различие между ДНК и РНК заключается в том, что в ДНК содержится тимин, а в РНК – урацил. Оба этих основания комплементарны аденину. Функция стоп-кодонов понятна из их названия – они отмечают конец кодирующей части гена
Узнав об открытии матричной РНК, Ниренберг, работавший тогда в Национальном институте здравоохранения США, заинтересовался, будет ли РНК, синтезированная in vitro, функционировать точно так же, как и естественная матричная форма при синтезе белков во внеклеточных системах. Чтобы узнать ответ на этот вопрос, он воспользовался РНК, специально модифицированной в соответствии с процедурами, которые шестью годами ранее были разработаны в Нью-Йоркском университете французским биохимиком Марианной Грюнберг-Манаго. Она открыла фермент РНК-полимеразу, позволявшую собирать последовательности вида АААААА или ГГГГГГ. А поскольку основное химическое отличие РНК от ДНК заключается в том, что в РНК на месте тимина (Т) стоит урацил (У), этот фермент также позволяет собирать урациловые цепочки – УУУУ, на жаргоне биохимиков «поли-У». Маршалл Ниренберг и его немецкий коллега Генрих Маттеи 22 мая добавили во внеклеточную систему именно поли-У. Результат был поразителен: рибосомы стали синтезировать простые белки, молекула которых представляла собой цепочку, состоящую из единственной аминокислоты – фенилаланина. Так они открыли, что поли-У кодирует фенилаланин. Следовательно, фенилаланин в генетическом коде должен обозначаться триплетом УУУ.
На Московском международном конгрессе, состоявшемся летом 1961 года, собрались все ключевые специалисты по молекулярной биологии. Маршалл Ниренберг в ту пору был молодым и никому не известным ученым. Ему отвели на выступление всего десять минут, и едва ли кто-то из специалистов по молекулярной биологии слышал его выступление. Но когда стали распространяться новости о его прорывном открытии, Крик подсуетился и выкроил ему время на выступление в один из следующих дней той же конференции, чтобы Ниренберг мог рассказать о своем открытии в аудитории, способной вместить всех заинтересованных. Это был исключительно важный момент. Спокойный, скромный и никому не известный молодой человек, выступая перед элитой молекулярной биологии, рассказал, что нужно сделать, чтобы полностью расшифровать генетический код.
Фактически Ниренберг и Маттеи решили всего лишь 1/64 часть задачи: определили, что УУУ кодирует фенилаланин. Оставалось расшифровать еще шестьдесят три трехбуквенных триплета (кодона), и последующие годы были отмечены многочисленными исследованиями, в ходе которых мы тщательно выясняли, какие аминокислоты кодируются другими кодонами. Оказалось, что самое сложное – синтезировать различные варианты РНК. Получить поли-У было относительно просто, а что насчет АГГ? Эти задачи решались при помощи различных хитроумных химических уловок, и многие из этих экспериментов были выполнены Гобиндом Хораной в Университете Висконсина. К 1966 году удалось выяснить значения всех шестидесяти четырех кодонов (иными словами, выстроить весь генетический код). В 1968 году Хорана и Ниренберг (совместно с Робертом Холли) получили Нобелевскую премию по физиологии и медицине.

Френсис Крик (в центре) с Гобиндом Хораной и Марианной Грюнберг-Манаго. После первого прорывного открытия, совершенного Маршаллом Ниренбергом, Гобинд Хорана открыл значительную часть генетического кода, опираясь на первопроходческие исследования Грюнберг-Манаго
Теперь давайте восстановим весь сюжет и рассмотрим, как синтезируется конкретный белок – гемоглобин.
Эритроциты специализируются на доставке кислорода из легких к тем тканям, где он требуется. Эритроциты образуются в костном мозге благодаря работе стволовых клеток – около 2,5 миллиона эритроцитов в секунду.
Когда возникает потребность в гемоглобине, расплетается соответствующий сегмент ДНК костного мозга – ген гемоглобина. Процесс в точности напоминает раздвоение ДНК при репликации. Но на этот раз копируются не две нити, а всего одна (по-научному «транскрибируется»), и в результате получается не новая нить ДНК, а новая нить матричной РНК, причем за синтез этой нити отвечает фермент РНК-полимераза. Этот сегмент матричной РНК соответствует гену гемоглобина. ДНК, с которой была скопирована эта РНК, вновь смыкается.
Матричная РНК выводится из ядра и доставляется в рибосому, которая сама состоит из РНК и белков. В рибосоме информация о последовательности нуклеотидов в матричной РНК используется для сборки новой белковой молекулы. Этот процесс называется «трансляция». Аминокислоты прибывают на место событий, прикрепленные к транспортной РНК. На одном кончике транспортной РНК расположен конкретный триплет (на приведенной здесь схеме это ЦАА), распознающий комплементарный ему противоположный триплет в матричной РНК, ГУУ. За другой кончик транспортной РНК прицеплена соответствующая аминокислота (в данном случае валин), буксируемая этой молекулой. На следующем триплете вдоль матричной РНК у нас становится транспортная РНК лизина, поскольку соответствующая последовательность в ДНК – это ТТЦ (кодирующая лизин). Теперь остается попросту биохимически склеить две аминокислоты. Сотня таких операций – и вот у нас есть белковая цепь длиной сто аминокислот. Порядок следования аминокислот зависит от порядка нуклеотидов А, Т, Г и Ц на том отрезке ДНК, по которому собирается матричная РНК. В молекуле гемоглобина две цепочки: в одной 141 аминокислота, в другой – 146.
Правда, белки – это не просто линейные цепочки аминокислот. После того как будет собрана такая цепочка, белки свертываются, образуя причудливые конфигурации. Иногда белок делает это сам, в других случаях – при помощи молекул, именуемых шаперонами. Белок становится биологически активным лишь после того, как приобретет нужную конфигурацию. Так, гемоглобин свертывается в четыре цепочки, причем цепочки в первой паре немного отличаются от цепочек во второй. Только после этого молекула приступает к делу. В центре каждой из этих цепочек расположен ключевой элемент, обеспечивающий транспортировку кислорода, – атом железа.
Сегодня удалось воспользоваться современными приемами молекулярной биологии, чтобы вернуться к некоторым классическим примерам из ранней истории генетики и переосмыслить их. Тот механизм, из-за которого одни горошины получались гладкими, а другие – морщинистыми, для Менделя оставался тайной; он считал, что есть лишь определенные признаки, подчиняющиеся законам наследования, которые он же и вывел. Однако теперь мы понимаем эту разницу в деталях на молекулярном уровне.
В 1990 году английские ученые обнаружили, что у гороха с морщинистыми зернами отсутствует один фермент, участвующий в переработке крахмала – углевода, запасаемого в семенах. Оказывается, что у гороха с морщинистыми семенами ген этого фермента не работает из-за мутации (в данном случае из-за интрузии ненужного фрагмента ДНК в середине гена). Поскольку в результате этой мутации морщинистые горошины содержат меньше крахмала и больше сахара, они быстрее теряют воду при созревании. Однако внешняя оболочка семени не сжимается при такой потере воды (и сокращении объема самого семени). Поэтому семя покрывается характерными морщинами – оно становится слишком маленьким для своей оболочки.




