С самого начала я был убежден, что проект «Геном человека» невозможно реализовать в рамках объединения огромного количества мелких лабораторий. Логистика безнадежно бы в них запуталась, и мы бы лишились всех преимуществ такого размаха и автоматизации, который предполагала цельность проекта. Поэтому с самого начала мы организовали центры по картированию генома в Вашингтонском университете Сент-Луиса, в Стэнфорде, в Калифорнийском университете Сан-Франциско, в Мичиганском университете (город Анн-Арбор), а также в Бэйлорском медицинском колледже в Хьюстоне. Министерство энергетики сначала сконцентрировало свои разработки в собственных лабораториях, расположенных в Лос-Аламосе и Ливерморе, но постепенно все они были передислоцированы в Уолнат-Крик, штат Калифорния.
Следующим пунктом «повестки дня» разработчиков проекта стала разработка альтернативных технологий секвенирования, призванных снизить общую стоимость работ до пятидесяти центов на каждую пару оснований, то есть примерно вполовину от запланированной стоимости. Были запущены несколько пилотных проектов. По иронии судьбы, тот метод, который в итоге себя оправдал, – автоматизированное секвенирование с применением флуоресцентных красок – на первом этапе у нас не заладился. Задним числом могу сказать, что пилотную стадию такой машинной обработки следовало доверить Крейгу Вентеру, штатному исследователю из Национальных институтов здравоохранения, который уже доказал, что способен выжать из любой методики максимум пользы. Он сам вызвался заняться решением этой задачи, но мы предпочли кандидатуру Ли Худа, автора этой самой технологии. Позднее мы еще не раз пожалели, что отказали Вентеру.
В конце концов, проект «Геном человека» не требовал разрабатывать с нуля совершенно новые методы анализа ДНК; речь шла, скорее, об оптимизации и автоматизации уже имеющихся методов, что постепенно позволило секвенировать пары оснований сначала сотнями, затем тысячами, а потом миллионами. Ключевую роль в проекте сыграл революционный метод генерации нужных сегментов ДНК в огромных количествах – метод амплификации. Для проведения секвенирования нужно было иметь много экземпляров того гена, который мы собирались изучать. До середины 1980-х годов амплификацию того или иного участка ДНК можно было выполнить лишь молекулярным клонированием по методу Коэна – Бойера: вырезали нужный сегмент, внедряли его в кольцевую плазмиду, затем видоизмененную плазмиду вставляли в бактериальную клетку, которая затем делилась, и при каждом делении у нас появлялся новый экземпляр нужного сегмента ДНК. После того как бактерии размножатся, мы вычленяли нужный сегмент из общей массы ДНК в бактериальной культуре. Со времени первых экспериментов Коэна и Бойера эта процедура была доработана, но все равно оставалась неудобной и затратной по времени. Огромным скачком вперед стало изобретение полимеразной цепной реакции (ПЦР), которая позволяла выполнить селективную амплификацию нужного фрагмента ДНК всего за пару часов, вообще без всякой возни с бактериями.
Полимеразная цепная реакция (ПЦР) была изобретена в 1983 году биохимиком Кэри Муллисом, работавшим в компании Cetus. Открытие этой реакции было весьма примечательным. Позже Муллис вспоминал: «Однажды пятничным вечером в апреле 1983 года меня словно озарило. Я был за рулем, катил по залитой лунным светом извилистой горной дороге в Северную Калифорнию, край секвойных лесов». Впечатляет, что именно в такой ситуации его посетило вдохновение. И дело совсем не в том, что на севере Калифорнии особенные дороги, способствующие озарению; просто его друг однажды видел, как Муллис безрассудно мчался по обледенелой дороге с двусторонним движением и это его совершенно не смущало. Друг рассказал New York Times следующее: «Муллису привиделось, что он погибнет, врезавшись в секвойю. Поэтому он ничего не боится за рулем, если вдоль дороги не растут секвойи». Наличие секвой вдоль дороги заставляло Муллиса сосредоточиться и… вот оно, озарение. За свое изобретение в 1993 году Муллис получил Нобелевскую премию по химии и с тех пор стал еще более странным в своих поступках. Например он является сторонником ревизионистской теории о том, что СПИД не связан с ВИЧ, чем значительно подорвал собственную репутацию и помешал врачам.
ПЦР – довольно простая реакция. Для ее проведения нам требуется два химически синтезированных праймера, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК. Праймеры – это короткие участки однонитчатой ДНК, каждый примерно по 20 пар оснований в длину. Особенность праймеров такова, что они соответствуют участкам ДНК, которые требуется амплифицировать, то есть ДНК-матрице.

Кэри Муллис, изобретатель ПЦР
Специфичность ПЦР основана на образовании комплементарных комплексов между матрицей и праймерами, короткими синтетическими олигонуклеотидами. Каждый из праймеров комплементарен одной из цепей двуцепочечной матрицы и ограничивает начало и конец амплифицируемого участка. Фактически полученная «матрица» представляет собой цельный геном, и наша цель – выделить из нее интересующие нас фрагменты. Для этого двухцепочечную ДНК-матрицу нагревают до 95 °C на несколько минут, чтобы цепи ДНК разошлись. Эта стадия называется денатурацией, так как разрушаются водородные связи между двумя цепями ДНК. Когда цепи разошлись, температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. ДНК-полимераза начинает репликацию ДНК, связываясь с отрезком цепи нуклеотидов. Фермент ДНК-полимераза реплицирует матричную цепь, используя праймер в качестве затравки или примера для копирования. В результате первого цикла получаем многократное последовательное удвоение определенного участка ДНК. Далее мы повторяем эту процедуру. После каждого цикла получаем участок-мишень в двойном количестве. Спустя двадцать пять циклов ПЦР (то есть менее чем через два часа) имеем интересующий нас участок ДНК в количестве, в 225 раза превышающем исходное (то есть мы амплифицировали его примерно в 34 миллиона раз). Фактически на входе у нас получалась смесь из праймеров, матричной ДНК, фермента ДНК-полимеразы и свободных оснований А, Ц, Г и Т, количество специфического продукта реакции(ограниченного праймерами) растет экспоненциально, а количество «длинных» копий ДНК линейно, поэтому в продуктах реакции доминирует.
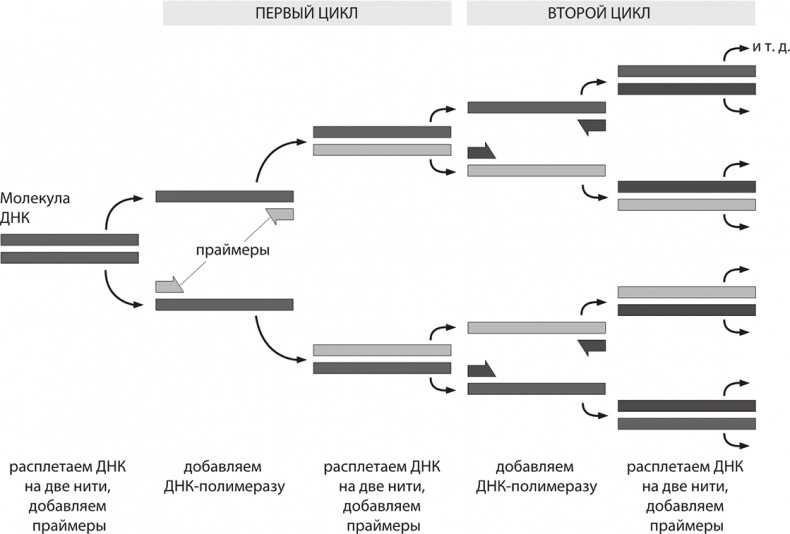
Амплификация нужного участка ДНК: полимеразная цепная реакция
На заре использования ПЦР основная проблема заключалась в следующем: после каждого цикла нагревания-охлаждения приходилось добавлять в реакционную смесь ДНК-полимеразу, так как она инактивировалась при температуре 95 °C. Поэтому нужно было заново добавлять ее перед каждым из 25 циклов. Процедура проведения реакции была сравнительно неэффективной, требовала много времени и фермента полимеразы, а материал это весьма недешевый. К счастью, на помощь пришла матушка-природа. Многие животные чувствуют себя комфортно при температуре гораздо выше 37 °C. А почему для нас стала важной цифра 37 °C? Это произошло потому, что данная температура является оптимальной для E. coli, из которой исходно получали фермент полимеразу для ПЦР. В природе встречаются микроорганизмы, чьи белки за миллионы лет естественного отбора стали более устойчивыми к действию высоких температур. Было предложено использовать ДНК-полимеразы из термофильных бактерий. Эти ферменты оказались термостабильными и были способны выдерживать множество циклов реакции. Их использование позволило упростить и автоматизировать проведение ПЦР. Одна из первых термостабильных ДНК-полимераз была выделена из бактерии Thermus aquaticus, обитающей в горячих источниках Йеллоустонского национального парка, и названа Taq-полимеразой.




