
Шанкар Баласубраманьян и Дэвид Кленерман из Кембриджского университета выпивают праздничную пинту в пабе Panton Arms, где они сформулировали принципы работы системы секвенирования нового поколения, применяемой в компании Solexa
При всей своей красоте этот метод с технологической точки зрения тоже был далеко не идеален. В частности, на первом этапе за каждый шаг удавалось считывать совсем мелкие фрагменты, всего по несколько десятков оснований каждый. Поэтому выстроить полную картину какого-либо генома было очень сложно. Тем не менее Solexa не сдавалась, и однажды воскресным вечером в феврале 2005 года Клайв Браун отправил старшим коллегам электронное письмо, тема которого была: «МЫ СДЕЛАЛИ ЭТО!!!» Им удалось успешно секвенировать свой первый геном – речь о геноме крошечного вируса ФХ174, секвенированием которого прославился в 1977 году и Фред Сенгер. Пусть это и был в буквальном смысле самый маленький геном на нашей планете, причем уже известный, это достижение стало ключевой вехой не только для компании Solexa, но и для всей новой эпохи секвенирования. Однако Браун с коллегами, в том числе новый гендиректор компании Джон Уэст, не поддались соблазну сразу открывать шампанское и публиковать статью с самопиаром в каком-нибудь престижном журнале. Они хранили молчание, оставляя Ротбергу и прочим по ту сторону океана догадываться, насколько они продвинулись в работе.
После принятого в 1999 году спонтанного решения основать компанию 454 Ротберг рассмотрел несколько стратегий развития и наконец остановился на новой методике под названием пиросеквенирование, ранее разработанной шведскими исследователями. Идея пиросеквенирования заключается в регистрации пирофосфата, который образуется при присоединении очередного нуклеотида ДНК-полимеразой. Детекция пирофосфата осуществляется за счет каскада химических реакций, который заканчивается выделением кванта света. Для реализации метода создается иммобилизованная на твердой фазе клональная библиотека одноцепочечных фрагментов ДНК. Ко всем фрагментам ДНК присоединяется адаптер, с которым будет комплементарно связываться праймер – затравка для синтеза комплементарной цепи ДНК-полимеразой. Далее производится серия последовательных циклов, в процессе которых к закрепленной на твердой фазе ДНК по очереди добавляют дезоксинуклеотидтрифосфаты всех четырех типов: A, T, Г, Ц. Если на секвенируемой цепи ДНК есть комплементарный к добавленному нуклеотиду, то при образовании фосфодиэфирной связи побочным продуктом станет пирофосфат. Он активирует каскад химических реакций: пирофосфат вместе с адено-зинсульфофосфатом (АСФ) при помощи фермента АТФ-сульфурилазы образуют АТФ, который является источником энергии для проведения реакции окисления фермента люциферина (фермент, обеспечивающий биолюминесценцию у светлячков) в оксилюциферин с выделением кванта света. Интенсивность выделяемого света пропорциональна числу включенных в цепь нуклеотидов (чем больше подряд одинаковых нуклеотидов, тем сильнее световой сигнал). Команда Ротберга состояла из талантливых ученых и программистов; один из инженеров даже участвовал в разработке телескопа «Хаббл». Успешная стратегия компании способствовала ее переходу на коммерческие рельсы.
Летом 2005 года компания 454 опубликовала статью (я прочел ее в журнале Nature), в которой был описан не только ее прибор GS20, но и методика секвенирования бактериального генома. В следующем году при помощи секвенатора GS20 учеными было успешно реализовано несколько проектов, упоминания о которых неизменно становились «научным хитом». Так, по кусочкам секвенировали геном неандертальца, идентифицировали вирус, из-за которого таинственно исчезали медоносные пчелы, и (это буквально сюжет для сериала «CSI: Место преступления») обнаружили редкий вирус, из-за которого умер европейский студент, пешком путешествовавший по Австралии. Наступила новая эра секвенирования. Технология крепла, Ротберг решил взяться за секвенирование генома реально живущего человека – и зародился проект «Джим». Хотя до «генома за 1000 долларов» было еще очень далеко, смета проекта «Джим» в один миллион долларов была ничтожно мала по сравнению с сотнями миллионов долларов, потраченных на первое секвенирование генома человека.
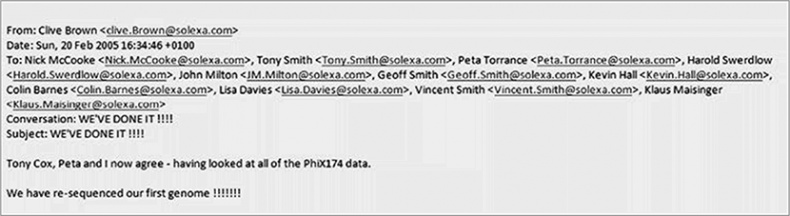
Маленький шаг вперед: внутрикорпоративное письмо руководителям Solexa, в котором сообщается о ключевом достижении – отсеквенирован первый геном крошечного вируса ФХ174
К апрелю 2008 года, когда статья об этом исследовании была опубликована в Nature (через 50 лет после публикации статьи о двойной спирали), у Ротберга и компании 454 развеялись всяческие сомнения по поводу поля и места деятельности. На ниве «новаторского секвенирования» становилось людно. В 2005 году талантливый профессор из Стэнфорда Стив Квейк опубликовал статью с описанием нового метода одномолекулярного секвенирования ДНК. Метод был применен для считывания всего пяти оснований, но это настолько впечатлило венчурного капиталиста и предпринимателя Стэна Лапидуса, что он немедленно полетел в Калифорнию, чтобы уговорить Квейка на открытие новой биотехнологической компании. Helicos сконструировала секвенатор, который позволил наблюдать на уровне единичной молекулы за синтезом комплементарной цепи одной молекулы одноцепочечной ДНК с помощью одной молекулы ДНК-полимеразы. В этой технологии флуоресцентно меченные нуклеотиды и конфокальная микроскопия высокого разрешения позволяют секвенировать последовательность в реальном времени и одновременно для многих полимераз. Лапидус окрестил его «генным микроскопом». С помощью этого микроскопа Квейк собирался секвенировать собственный геном за каких-нибудь 50 тысяч долларов. Увы, компания Helicos столкнулась с технологическими сложностями и разорилась, но ее технологиями по-прежнему пользуются некоторые весьма солидные фирмы.
Компания Pacific Biosciences (PacBio) коммерциализировала технологию одномолекулярного секвенирования. В основе метода лежало использование Zero-mode waveguide (ZMW) – углублений диаметром несколько десятков нанометров, ко дну которых прикреплена единичная молекула ДНК-полимеразы. Сквозь дно в ZMW-ячейку подается свет в виде крошечного прожектора, который специалисты именуют «волновод нулевой моды». Особенность конструкции ZMW-ячейки не дает распространяться световой волне и оставляет освещенным только объем порядка 20 цептолитров (20 × 10–21 литров) около дна ячейки. Компания PacBio использовала ту же самую технологию, которая применяется на сетке в дверце вашей микроволновки; сетка не допускает утечки микроволн, пока вы наблюдаете, как ваша курочка карри шкворчит внутри. Технологические новшества позволили наблюдать флуоресценцию единичной флуорохромной метки, прикрепленной к тому нуклеотиду, который в данный момент встраивается ДНК-полимеразой. Соответственно, к четырем типам нуклеотидов пришиты разные флуоресцентные метки, что позволяет их идентифицировать. В результате при полимеризации цепи ДНК зафиксированным в Zero-mode waveguide ферментом можно получить зависимость интенсивности флуоресценции от времени, из графика которой по пикам разного спектра затем и будет определена последовательность ДНК.




