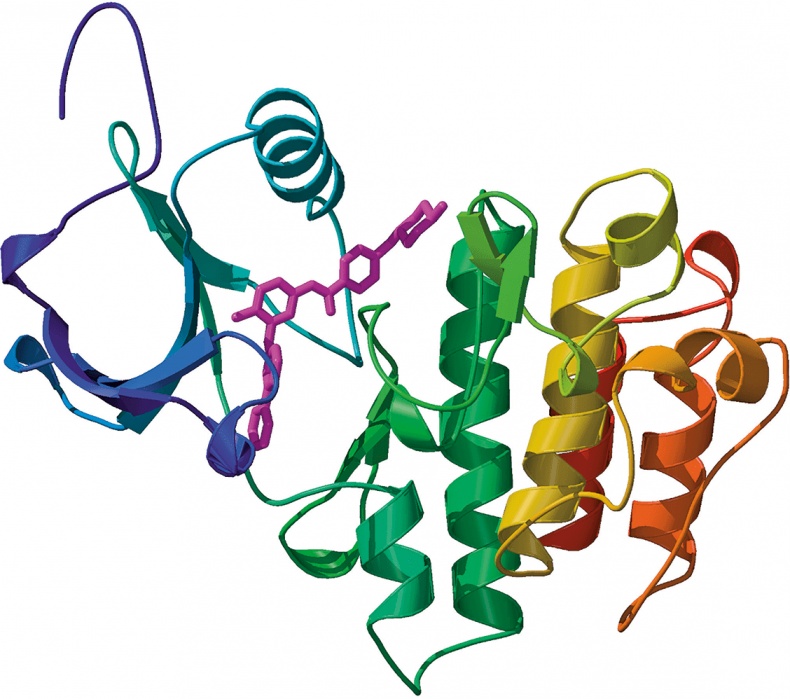
Протеомика: трехмерная структура белка BCR-ABL, вызывающего рак. Слияние двух генов, вызванное хромосомной аномалией, приводит к синтезу этого гибридного белка, вызывающего пролиферацию клеток и провоцирующего одну из форм лейкемии. Сиреневым показан препарат Gleevec, селективный ингибитор BCR-ABL (см. главу 14). Работа с такой трехмерной моделью помогает при разработке лекарств. (В структурной модели BCR-ABL не демонстрируются детали атомов или отдельных аминокислот, тем не менее компоновка белка передана точно.)
Представление об объемной структуре белка значительно облегчает работу химиков-фармацевтов, занятых поиском новых действенных лекарств (терапевтическая функция многих препаратов основана на ингибировании действия определенных белков). В нашем все более специализированном и автоматизированном мире фармацевтических исследований появились компании, предлагающие услуги по определению структуры белка, словно белок – штампованная конвейерная продукция. Теперь такая работа выполняется проще, чем во времена Перуца и Кендрю: появились более мощные рентгеновские облучатели, автоматизировалась запись данных, сами компьютеры стали гораздо быстрее, а их программы – интеллектуальнее. Поэтому расшифровка структуры белка теперь может занимать не годы, а считаные недели. В конце 2015 года в «базе данных белков» содержались атомные структуры более 26 тысяч человеческих белков.
Однако сплошь и рядом трехмерная структура как таковая ничего не говорит о функции белка. Напротив, важные подсказки можно получить, изучая, как именно неизвестный белок взаимодействует с белками-партнерами, ранее известными. Простой способ идентификации таких взаимодействий (BiFC) заключается в следующем: в условиях in vitro известный белок соединяем с неизвестным, обработанным флюорохромной меткой, флюорохром подбираем таким образом, чтобы испускаемое излучение было видимым в ультрафиолете. Остается обнаружить флуоресцентные сигналы заметной интенсивности взаимодействующих белковых комплексов. В таком случае можно предположить, что и внутри клетки два этих белка должны взаимодействовать. BiFC-подход существенно облегчил визуализацию сайтов белковых взаимодействий на субклеточном уровне.
В идеале, чтобы знать «сценарий» жизни и видеть, как разворачивается действие «фильма» под названием жизнь, требуется открыть все мельчайшие изменения в составе белка, происходящие в процессе развитияособи, от оплодотворения до зрелой особи. На протяжении этого процесса действует множество белков, некоторые оказываются специфичны для конкретного этапа развития, поэтому в каждой фазе роста предстоит увидеть в действии различные совокупности белков. Например, гемоглобин зародыша и взрослой особи слегка различаются. Аналогично каждая разновидность ткани синтезирует собственные профильные белки.
Наиболее надежный способ отсортировать различные белки из имеющегося образца ткани – по-прежнему все тот же проверенный метод гельфореза с использованием двумерных гелей для разделения белковых молекул на основе различий их электрического заряда и молекулярной массы. Разделенные таким образом несколько тысяч белковых проб также можно проанализировать при помощи метода масс-спектрометрии, позволяющего исследовать состав белка на основании определения отношения массы к заряду ионов, образующихся при ионизации представляющих интерес компонентов пробы. Таким образом можно определять молекулярную последовательность каждой аминокислоты. Прошло более десяти лет после завершения проекта «Геном человека», а приблизительная карта человеческой протеомы еще не была построена. В 2014 году два консорциума наконец-то достигли этой цели. Проанализировав 30 разных тканей, они смогли каталогизировать 84 % белковых продуктов человеческого организма. В ходе этой работы были открыты сотни новых белков, в том числе продукты длинных, протяженных межгенных некодирующих РНК. С большой долей уверенности можно говорить, что каталог протеомики незаменим для понимания человеческого генома, хотя господствующая на сегодняшний день точка зрения – что информация передается от генома к РНК (транскриптома) и далее к белкам (протеома). Благодаря наличию новых данных, выложенных в открытый доступ, фармацевтические компании получили данные для работы на десятилетия вперед.
По сравнению с высокопроизводительной протеомикой, где применяются дорогое оборудование и автоматизация в промышленном масштабе, практическая транскриптомика на деле оказалась гораздо дешевле и проще: функционирование всех генов в геноме можно отследить, измеряя относительное содержание продуктов матричной РНК (мРНК) каждого из белков. Если вам интересно, какие гены экспрессируются, скажем, в клетках человеческой печени, вы выделяете образец мРНК из тканей печени. Получается «снимок» популяции мРНК в печеночной клетке: самые активные гены, транскрибируемые чаще всего и продуцирующие множество молекул мРНК, будут представлены более многочисленной популяцией, но если ген транскрибируется редко, в образце окажется всего несколько экземпляров его мРНК.
Ключом к транскриптомике стало на удивление простое изобретение под названием «ДНК-микрочип». Представьте себе стеклянную пластину размером 12,8 × 12,8 мм, на которую в виде сетки нанесены десятки или сотни тысяч крошечных точечных отверстий (они вытравлены в стекле). В эти отверстия с помощью микропипетки вносим последовательности ДНК от конкретного гена, они составят матрицу, в которой будет локализован один из генов человеческого генома. Критически важно, что мы знаем, где именно на этой пластине локализован каждый ген ДНК. Компания Affymetrix, расположенная близ Стэнфорда, смогла изготовить еще более миниатюрные чипы, вытравив их на кремниевой пластине такого размера, что применяются в небольших компьютерах. Так и получился «ДНК-чип». Ученый Марк Чи, основавший Affymetrix, также был сооснователем компании Illumnia, ставшей крупнейшим поставщиком на рынке таких микрочипов.
При помощи стандартных биохимических методов можно помечать печеночные мРНК химическим флуоресцентным маркером, так что вышеупомянутые белки обязательно будут флуоресцировать в ультрафиолете. На следующем этапе во всем своем великолепии проявляется вся сила и простота метода: просто сливаем наш образец мРНК на микрочип, где нас уже ждет миниатюрная пластинка с отверстиями, в которые уже внесены конкретные гены. Те самые связи, что возникают при спаривании оснований и удерживают вместе две нити двойной спирали, заставят каждую молекулу мРНК прикрепиться к тому гену, которому она комплементарна. Комплементарность точна и совершенно безошибочна: мРНК от гена X закрепится лишь в том отверстии в микрочипе, где находится ген X. На следующем этапе остается зарегистрировать флюоресценцию мРНК. На каких-то участках мы не увидим флюоресценции, и это будет обозначать, что комплементарной ему мРНК в образце не было. Следовательно, можно сделать вывод о том, что активной транскрипции этого гена в печеночных клетках не происходит. В то же время многие участки заметно флуоресцируют, некоторые – особенно интенсивно; это означает, что к ним прикрепилось множество молекул мРНК. Вывод: мы выявили очень активный ген. Таким образом, при помощи единственного экспериментального анализа мы идентифицируем все без исключения гены, активные в клетках печени. Такие молекулярные обзоры стали реальностью благодаря успешности проекта «Геном человека» и новому мировоззрению, которое проект привнес в биологию: исследователи больше не удовлетворяются изучением разрозненных фрагментов, они рассматривают полную картину генома во всей его великолепной красоте. Стоит ли удивляться тому, что Пэт Браун из Стэнфорда, один из ведущих практикующих специалистов, использующих этот метод, считает ДНК-микрочипы «новой разновидностью микроскопа».



