Такая генетическая мутация зафиксирована только в Японии, однако перед научным миром стоит задача так же модифицировать наши собственные гены. Вместе с тем вопрос генетической модификации обращает нас к серьезным проблемам этического и морального планов, и поэтому нам следует искать другие альтернативы: на генной инженерии свет клином не сошелся.
Если утечка электронов из ЭТЦ приводит к образованию свободных радикалов, лучший способ предотвратить такое развитие событий — снизить количество электронов, передаваемых по ЭТЦ (как говорится, меньше электронного «народа», больше нормального — не принявшего форму супероксида — кислорода). Судя по всему, именно этот механизм используют птицы. Но как уподобиться птицам можем мы, люди? Мы могли бы увеличить число цепей переноса электронов на каждую митохондрию для того, чтобы распределить электронную нагрузку между ЭТЦ. Но этот показатель определяется на генном уровне, и поэтому его не так просто изменить. Легче уменьшить количество электронов, для чего и предназначены низкокалорийные диеты, которые сейчас являются единственным способом, позволяющим увеличить максимальную продолжительность жизни.
Есть множество других путей восстановления, сохранения и упрочения здоровья наших митохондрий. Можно создать больше митохондрий, можно обеспечить быстрый перенос электронов по ЭТЦ (чтобы новые электроны не задерживались на проходе), можно рассеивать протонный градиент в виде тепловой энергии и т. д. Вопрос заключается в следующем: как мы делаем это?
Известно, что большинство клеток генерирует 60–70 % своей энергии с помощью метаболизма жирных кислот. Однако без достаточного запаса БАВов, таких как L-карнитин, доставляющих жирные кислоты в митохондрии (а также удаляющих токсичные метаболиты), производство клеточной энергии будет неэффективным (как я уже упоминал выше, такое положение вещей является началом конца). То же самое верно и по отношению к коферменту Q10. Стивен Синатра, кардиолог и один из ведущих специалистов в области метаболической терапии в кардиологии, на протяжении 20 лет фиксировал уровень кофермента Q10 у сотен пациентов и обнаружил, что концентрация этого критически важного компонента ЭТЦ находится на пугающе низком уровне у гораздо большего количества людей, чем было принято считать. Кроме того, выяснилось, что статины (очень популярные и сильнодействующие медикаменты, которые применяются для нормализации уровня холестерина) блокируют синтез кофермента Q10. (Отсюда следует, что с дефицитом этого вещества сталкивается множество людей, которые подсажены на этот коэнзим.) Аналогичное воздействие оказывают такие препараты, как бета-адреноблокаторы, гипогликемические (диабетические) лекарства и трициклические антидепрессанты. Все это накладывается на естественное падение уровня кофермента Q10 с возрастом.
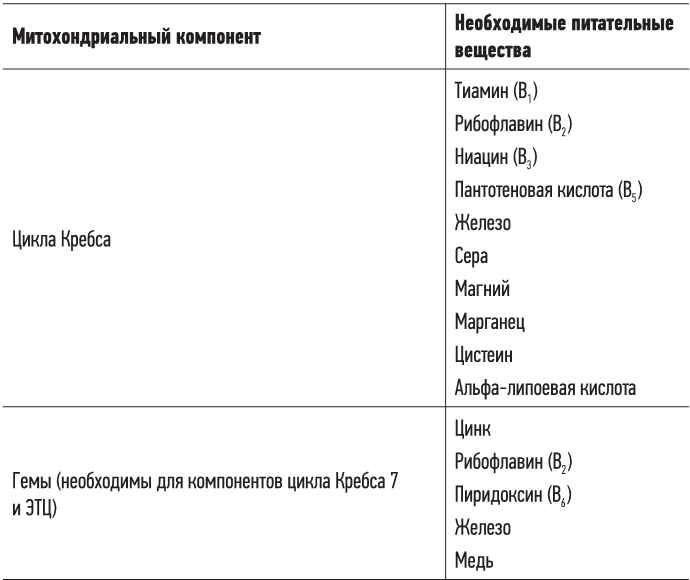
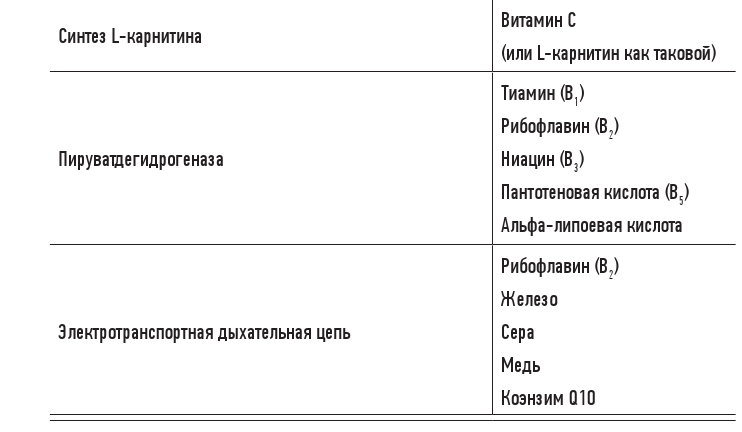
Кроме того, вегетарианцы, а особенно веганы, в большинстве случаев тоже испытывают дефицит кофермента Q10 и L-карнитина, потому что основным источником многочисленных питательных веществ для митохондрий является мясо. (Съедая мясо, мы поглощаем митохондрии животных и их компоненты. У растений есть хлоропласты, которые похожи на митохондрии, но все же значительно от них отличаются.) В табл. 3.1 перечислены эти вещества.
Вскоре вы узнаете, как другие питательные вещества, такие как D-рибоза, дополняют представленную выше картину и почему они столь важны для тех, кто страдает от заболеваний, вызванных митохондриальной дисфункцией. Кроме того, необходимо поговорить о значимости магния — всем известного и жизненно важного микроэлемента. Ионы магния почти всегда прикрепляются к АТФ во внутреннем пространстве клетки (он понижает электрический заряд энергетической макромолекулы и помогает ей перемещаться внутри клетки). Многое из того, что мы рассмотрим ниже, относится к области метаболической терапии в кардиологии в целом и к индивидуальным работам Синатры в частности. Мы попробуем ответить на вопросы о том, почему пациенты с заболеваниями сердечно-сосудистой системы чувствуют себя хуже спустя несколько дней спустя прохождения стресс-теста. Речь идет о нагрузках, которые испытуемые получают на беговой дорожке и которые резко повышают потребность их организмов в кислороде и временно вызывают состояние гипоксии (дефицита кислорода в организме или отдельных органах и тканях). После прекращения нагрузки гипоксия, по идее, должна исчезнуть. Но почему тогда пациенты продолжают испытывать усталость, слабость, повышенную утомляемость и нехватку воздуха на протяжении нескольких суток после тестирования? Как вы могли догадаться, все это связано с митохондриальной энергией!
Таблица 3.1. Питательные вещества для митохондрий
Следует выявить факторы питания и образа жизни, которые способствуют активному производству клеточной энергии и восстанавливают митохондриальную функцию. Конечно, приведенный в этой книге перечень факторов (БАВ и вариантов терапии) далеко не исчерпывающий. Я был вынужден ограничить его, иначе процесс подготовки рукописи к изданию стал бы бесконечным (соответствующие изыскания и так потребовали порядка двух лет).
D-рибоза
Проведенные в 40–50-х годах прошлого века исследования показали, что D-рибоза — простой пятиуглеродный сахар, синтезируется и используется в рамках важного процесса под названием пентозофосфатный путь. До тех пор пока ученые не установили этот факт, предполагалось, что такой уникальный сахар является структурным компонентом молекул ДНК и РНК.
D-рибоза, которая является структурным компонентом АТФ, очень важна для синтеза энергии. Однако до начала 70-х гг. ученые не знали, что прием D-рибозы до или сразу после приступа ишемической болезни сердца пациентами с сердечной недостаточностью позволяет восстановить энергетический уровень их клеток.
В 1991 году были опубликованы результаты первого клинического исследования применения D-рибозы в кардиологии. Исследователи предположили, что части сердца, затронутые ишемией и гипоксией, не отмирают, а просто переходят в спящий режим, консервируя энергию до того времени, когда в полной мере восстанавливается их кровоснабжение, а также снабжение кислородом. После этого они начинают производить докризисные объемы энергии и нормально функционировать.
Цель этого исследования заключалась в том, чтобы определить, какие именно части сердца нуждаются в потоках свежей крови посредством аортокоронарного шунтирования. Если они действительно только спят, то хирург может разбудить их, направив туда новые кровеносные сосуды (мертвая же ткань, естественно, оживлению не подлежит).
Следует отметить, что в ходе работы исследователи получили результаты, очень значимые не только для людей, страдающих от ишемии и гипоксии, но и для всех нас. Посредством введения в организм испытуемых D-рибозы и восстановления пула пуриновых соединений и энергетических ресурсов исследователи в самом деле сумели пробудить к жизни впавшие в анабиоз части сердца, доказав выдвинутую гипотезу.

