Батарейка обеспечивает прибор энергией, то есть потоком электронов, служит их портативным донором и устроена по следующему принципу.
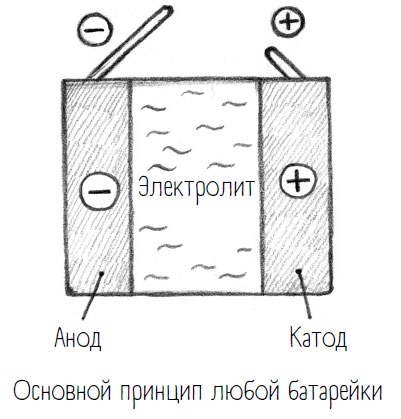
Важнейшие компоненты батарейки – электроды: один на положительном полюсе, другой на отрицательном. Положительно заряженный электрод называется катодом, отрицательно заряженный – анодом. Полюса соединены между собой проводящим кабелем, который проложен через мобильник и снабжает его компоненты энергией, то есть электроны идут от анода к катоду через мобильник. Внутри батарейки электроды тоже соединены – через так называемый электролит (это собирательное название жидкостей или твердых веществ, способных проводить электрический ток). Однако электролиты проводят не электроны, а ионы – как положительные, так и отрицательные. Кстати, мы сами большей частью состоим из электролита, то есть из воды с разнозаряженными ионами.
Грубо говоря, батарейка – это катод, анод и электролит. А какие химические вещества для каждого из этих компонентов используются, зависит от типа батареи.
В литий-ионной батарее катод обычно состоит из соединения лития, кислорода и еще одного металла, например кобальта. Все вместе получается оксид лития-кобальта. Атомы кобальта и кислорода образуют слои, между которыми заключены ионы лития.
Анод чаще всего состоит из графита, то есть по сути из углерода. Графит также уложен слоями.
Подключая мобильник к зарядному кабелю, я подаю на батарейку обратное напряжение. И тут происходит нечто, что приводит к путанице в терминах. Вот мы только что узнали два новых понятия – анод и катод, – и нам уже придется поменять их местами. Когда батарейка заряжается, положительные электроды из оксида лития-кобальта мы называем анодами, а отрицательные электроды из графита – катодами. То есть точно наоборот, чем при разрядке батарейки. Зачем химикам так все усложнять? Это имеет кое– какое отношение к происходящим в электродах химическим реакциям. К этому мы еще вернемся, но пока, пожалуй, следует разобраться с положительным и отрицательным полюсами.
Когда я заряжаю мобильник, отрицательный полюс заряжается электронами, перемещающимися в графит. В результате загрузки возникает переизбыток отрицательного заряда. Это в принципе усложняет зарядку, потому что одинаковые заряды отталкиваются друг от друга, то есть отрицательный от отрицательного, а положительный от положительного. Поэтому не получится так запросто полностью накачать электроды отрицательно заряженными электронами. Но противоположные заряды взаимно компенсируются, потому здесь в игру вступают положительно заряженные ионы лития, дающие название литий-ионной батарейке. Они ускользают из положительного полюса (электрод из оксида лития-кобальта), проходят через электролиты до графитового электрода и там, на отрицательном полюсе, получают отрицательные электроны. Это называется компенсацией зарядов – она обеспечивает полную зарядку электронами.
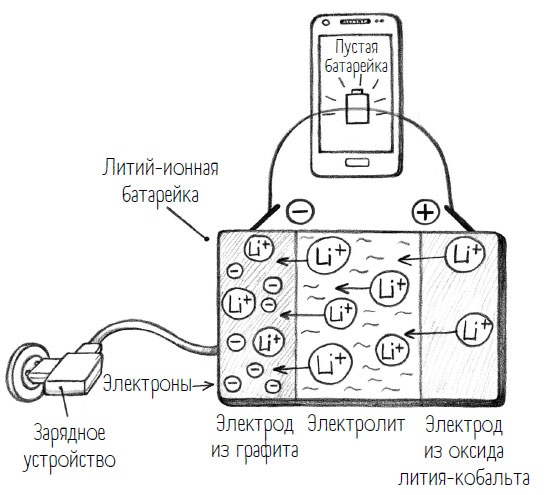
Теперь электроны не околачиваются просто так где-то «на районе», а приняты самым сердечным образом. Для химиков среди моих читателей приведу уравнение этой реакции: Сn + xLi+ + xe– = LixCn. Не-химикам не стоит беспокоиться; вам здесь вообще-то интересна только одна часть этого уравнения, а именно «+ xe-». «Х» здесь означает просто любое количество, а «е-» – электрон, а все вместе говорит о том, что в этой химической реакции были приняты электроны. Это называют восстановлением. Восстановление в химии – это реакция, при которой атомы или ионы присоединяют электроны (а степень окисления понижается).
Поскольку теперь я полностью «заправила бак» (отрицательный полюс своего мобильника) электронами, а положительный полюс электронов не содержит, тем самым между двумя полюсами создается электрическое напряжение. Давайте представим электрическое напряжение как перепад высот для потока электронов по аналогии с плотиной на реке. Загрузить отрицательный полюс электронами – все равно что поднять воду снизу наверх. Если теперь открыть шлюз, вода водопадом грохнется вниз. Именно это и происходит, когда я вынимаю зарядный кабель. При пользовании мобильником химическая реакция поворачивается вспять: принятые электроны снова отдаются. Теперь в качестве электрического тока они носятся по всему мобильнику. Реакция, противоположная восстановлению, называется окислением. Окисление – это химическая реакция, при которой электроны отдаются.
Теперь, когда отданные электроны стимулируют работу моего мобильника, литий-ионы отправляются обратно через электролит. На другой стороне, на положительном полюсе, электроны и литий– ионы снова встречаются. Когда все электроны возвращаются на другую сторону, батарейка оказывается пуста, и все можно начинать сначала!
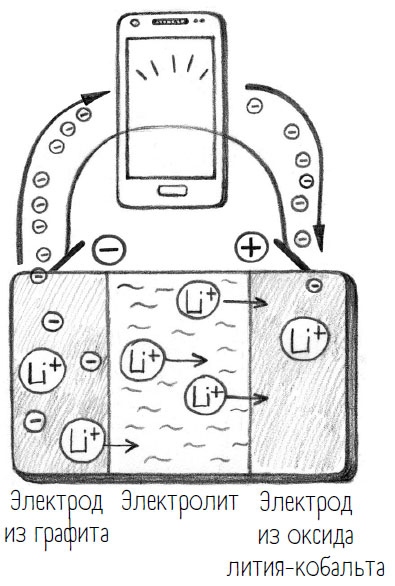
Теперь давайте вернемся к путанице с терминами «катод» и «анод». В батарейке, перезагружать которую я не могу, катод – это всегда положительный полюс, а анод – отрицательный. Но в перезагружаемых батарейках это верно лишь наполовину, ведь мы только что видели, что зарядка и разрядка – это два противоположных химических процесса, поэтому определение катода и анода здесь следует уточнить. Анод – это электрод, на котором происходит окисление, а катод – электрод, на котором происходит восстановление.
При зарядке мобильника на отрицательном полюсе происходит восстановление, на положительном – окисление. Когда батарея разряжается – наоборот. Таким образом, окисление и восстановление всегда идут параллельно и никогда не происходят поодиночке. Здесь, как в межличностных отношениях, действует принцип «брать и давать»: брать = окисление (по-английски reduction), давать = восстановление (по-английски oxidation). Отсюда общий для обеих реакций термин – реакции редокс (redox). На этом вы справились с вводным курсом по окислительно-восстановительным реакциям, с чем вас сердечно поздравляю!
* * *
Бытует мнение, что прежде, чем заряжать мобильник, нужно по возможности разряжать его до конца и следить за тем, чтобы он не слишком долго оставался на зарядке. Это верно для никелевых батареек – тех, например, что в пультах дистанционного управления для телевизоров, старых свинцово-кислотных батареек это тоже касается. А современные литий-ионные батареи можно оставлять подключенными к зарядному устройству сколь угодно долго, потому что они устроены так, что зарядка автоматически останавливается, когда аккумулятор заряжен. Иначе смартфон стал бы довольно опасной штукой. И даже, было дело, действительно стал таковой, когда в 2016 году у пользователей начал вдруг взрываться Samsung Galaxy Note 7. Внутри батарейки вещества, буквально наполненные энергией, надежно защищены от внешнего мира и потенциальных реагирующих веществ. Но при экстремальном нагревании, повреждениях корпуса батарейки или конструктивных дефектах, которые ведут к перегрузке, возникают неприятности. В сочетании с входящими в состав электролита легковоспламеняющимися растворителями получается та еще мини-бомба.





